(2: 湖北省地质环境总站, 武汉 430034)
(2: Geological Environmental Center of Hubei Province, Wuhan 430034, P.R. China)
新烟碱类杀虫剂是世界上大多数国家使用最广泛的杀虫剂。其中,吡虫啉(Imidacloprid, IMI)作为第一个上市的新烟碱类杀虫剂,其相关产品一直主导着全球杀虫剂市场,IMI也是第一代新烟碱类杀虫剂的典型代表[1]。目前,IMI被广泛应用于农业生产活动中,由于其高水溶性以及在水和土壤中的高持久性和难挥发性,导致IMI在全球地表水系统中常被检测到,例如,IMI是珠江三角洲表层水中最常检测到的新烟碱类化合物,鄱阳湖流域水体中IMI的检出率为100%,且检出浓度最高[2-3]。地表水中IMI的存在会不断危害水生态系统,从而影响水生生物的生理代谢活动,甚至会导致水生生物死亡。IMI对藻类、溞类、蛙类和几种鱼类等本土水生生物产生活动抑制、生长、DNA损伤和致死影响[4-7]。在较高IMI浓度时,鲤科鱼类(Cyprinus Carpio、Carassius auratus、Ctenopharyngodon idella)会出现多种生理影响,包括虚弱、螺旋游泳、呼吸困难、痉挛和死亡等[7]。当蚤状溞(Daphnia pulex)接触到IMI时,24和48 h的LC50分别为1.5和1.09 mg/L,随着杀虫剂浓度的增加,D. pulex的死亡率成比例增加,在1、1.2、1.4和1.8 mg/L浓度下,D. pulex 24 h后的死亡率分别为20%、30%、40%和60%[8]。此外,已有研究表明高浓度IMI对中华绒螯蟹(Eriocheir sinensis)的影响主要通过抑制酶活性和肠道菌群失调来诱导氧化应激,抑制解毒系统[9]。鉴于IMI在水环境中的高检出频率及其对水生物种的毒性作用,制定IMI的水质标准以保护中国水生生物,并开展生态风险评估至关重要。
水质基准是水中污染物的阈值浓度,旨在保护生活在水中的生物免受不利影响。研究者们通常使用毒性百分数排序法(toxicity percentage rank method, TPR)和物种敏感度分布法(species sensitivity distribution, SSD)来推导水质基准[10]。其中,SSD是一种与生态系统中单个生物物种的毒性阈值相匹配的累积概率分布。在澳大利亚和新西兰,SSD已被正式用于制定污染物的水质基准[11]。最近,我国生态环境部也推荐SSD作为制定污染物水质标准(water quality criteria, WQC)的标准方法(《淡水生物水质标准制定技术导则》,第一版为HJ 831—2017,已更新为HJ 831—2022),尤其是当不同类群的水生生物毒性数据充足时,该方法更为适用[12-13]。该方法已被利用推导了水生系统中土霉素、甲基叔丁基醚等的生态安全阈值[10, 14]。目前大多数关于SSD的研究忽略了毒性数据中本土和非本土物种之间的差异。然而从理论上来看,引入非本土物种并不能充分反映本土生态系统的敏感性。尽管一些研究表明,使用本土物种和非本土物种推导得到的生态阈值并没有显著差异,但这些研究仅限于少数污染物,如2, 4-二氯苯酚和五氯苯酚[15-16]。由于地理区域间生物多样性存在差异,使用非本土物种构建的SSD的可靠性一直备受争议,且非本土物种并不能完全代表本土生物群落这一观点已得到广泛认可[17]。因此,为了得到可靠的本地水生生物水质基准,基于本土物种构建SSD开展研究十分重要。
目前欧盟和新西兰依据当地政策得出了IMI的水质标准[18-19],我国鲜有对于新烟碱类杀虫剂的水质基准及生态风险评估领域的相关工作[20]。因此,本研究尝试用SSD方法,基于本土物种推导IMI的水质基准。首先,本研究通过数据库检索和文献调研方法对IMI的毒性数据进行收集和筛选,构建IMI对本土水生生物的敏感度分布曲线,计算IMI对水生生物的反映95%物种未受影响的浓度(hazardous concentration for 5%of species, HC5)值,并推导了IMI的水生生物水质基准。最终结合该水质基准,采用商值法对我国主要流域地表水的IMI暴露生态风险进行评估,以期为我国地表水环境质量标准的制定提供建议,同时为水环境风险管控和水生态系统保护提供参考。
1 材料与方法 1.1 水生生物毒性数据的收集与筛选本文关于IMI的淡水水生生物毒性数据获取自美国环境保护局ECOTOX毒性数据库(http://cfpub.epa.gov/ecotox/)、中国知网(http://www.cnki.com/)和web of science (http://apps.webofknowledge.com/)检索出的文献。收集的毒性数据按照我国标准推导方法(《淡水生物水质标准推导技术导则》(HJ 831—2022))中推荐的规则进行筛选。一般来说,试验生物应是淡水物种,优先采用了中国淡水生物水质基准推导受试物种推荐名录中的物种,其他所选中的物种依据《中国动物志》和《中国生物物种名录》,以筛选获得分布于我国境内的淡水生物[10]。毒性数据统计截至时间为2022年12月。
有关暴露时间的筛选,急性毒性数据中(EC50或LC50),轮虫的暴露时间约为24 h,溞类和摇蚊的暴露时间约为48 h,其他动物的暴露时间则为96 h左右,对于植物而言,适宜的暴露时间为96 h左右。慢性毒性数据方面,轮虫的暴露时间应≥48 h,而其他动物则需要暴露≥21 d或覆盖一个敏感生命阶段,植物适宜的暴露时间应≥21 d或至少跨越一个世代。关于毒性数据筛选的优先级,急性毒性数据通常为LC50或EC50,慢性毒性数据的优先性为MATC>EC20>EC10=NOEC>LOEC>EC50>LC50。
1.2 SSD模型的拟合本研究采用基于MATLAB的SSDToolbox软件进行数据拟合,并通过对数正态分布(Log-normal)和对数逻辑斯谛分布(Log-logistic) 2种模型,拟合IMI对水生生物的SSD曲线,推导HC5值。关于最优拟合模型的选取,则是通过最大似然估计拟合建模,采用Anderson-Darling检验和赤池信息准则(Akaike's information criterion, AIC) 等方法评估拟合优度,从而选取最优拟合模型。AIC值的数值越小,表明其拟合程度越好。最佳模型确定了5%物种的危险浓度(HC5),即应该保护生态系统中95%的物种的浓度。本研究基于水生生物的急性毒性值,推导IMI的短期水质基准(short-term water quality criterion, SWQC);基于水生生物的慢性毒性值,推导IMI的长期水质基准(long-term water quality criterion, LWQC)。随后可依据拟合结果得到的HC5值进行水质基准计算,具体计算公式为:
| $ S W Q C=H C_{5 \text { 急性 }} / A F $ | (1) |
| $L W Q C=H C_{\text {5慢性 }} / A F$ | (2) |
式中,AF为评价因子,当所收集的有效毒性数据量>15时,AF取2;有效毒性数据量≤15时,AF一般取值为3[13]。
1.3 生态风险评估本研究运用风险商值法(risk quotients, RQ)计算出的风险商对我国部分水体报道的含IMI淡水水域进行生态风险初步评价,其中,风险商值等于地表水实测的IMI浓度与推导的长期水质基准阈值的比值[10]。其计算公式为:
| $RQ=MEC/LWQC$ | (3) |
式中,RQ为风险商值;MEC为测定的IMI浓度;LWQC为IMI的长期水质基准。
当RQ值<0.01时,说明该水域IMI暴露浓度很低,水环境无风险;当0.01≤RQ值<0.1时,说明该水域IMI暴露浓度较低,水环境相对安全,为低风险;当0.1≤RQ值<1时,说明该水域IMI暴露浓度一般,水环境安全受到一定威胁,为中风险;当RQ值≥1时,说明该水域IMI暴露浓度较高,存在显著的生态风险,为高风险;其风险程度与风险商值呈正比[21]。
2 结果与讨论 2.1 IMI的毒性数据按照上述标准对毒性数据进行筛选,本研究共收集了来自21个物种的平均急性毒性值,涵盖5门14科,各物种详细数据如表 1所示。本研究共收集了15个物种的平均慢性毒性值,涵盖5门11科,各物种详细数据如表 2所示。急、慢性毒性数据都至少包括10个物种,涵盖了生产者(藻类)、初级消费者和次级消费者3个营养级,满足《淡水生物水质基准推导技术指南》(HJ 831—2022)的最少毒性数据需求。
| 表 1 吡虫啉的水生生物急性毒性数据 Tab. 1 Acute aquatic toxicity data of IMI |
| 表 2 吡虫啉的水生生物慢性毒性数据 Tab. 2 Chronic aquatic toxicity data of IMI |
急性毒性数据中,对IMI暴露最敏感的物种是蜉蝣,最不敏感的是南亚野鳞,种平均急性值分别为0.00849和550 mg/L。慢性毒性数据中,最敏感的动物是伸展摇蚊,最不敏感的是南亚野鲮,种平均急性值分别为0.00072和120 mg/L。其中,所有鱼类毒性数据的平均值大于整体毒性数据平均值,表明鱼类对于IMI暴露普遍具有较高的耐受性。Qadir等[24]研究了IMI暴露对南亚野鲮体内几种生化指标的影响,结果表明IMI暴露下南亚野鲮的血红蛋白、红细胞和血小板值显著降低,南亚野鲮贫血严重。血清谷丙转氨酶、谷草转氨酶和乳酸脱氢酶的显著升高表明农药暴露对鱼肝脏生理功能的影响。在长期实验中观察到IMI对南亚野鲮的影响不太严重,这表明南亚野鲮生理变化和IMI暴露时间之间呈负相关。鲤科鱼类具有较高的生态可塑性和较强的适应性,普遍存在于我国湖泊和池塘中[7]。已有研究发现IMI对鲤科鱼类(Cyprinus carpio、Carassius auratus、Ctenopharyngodon idella)具有中度急性毒性,在较高浓度(取决于种类)时观察到不活动、潜水突然、虚弱、螺旋游动、缺乏平衡、呼吸缓慢、痉挛和死亡等症状。
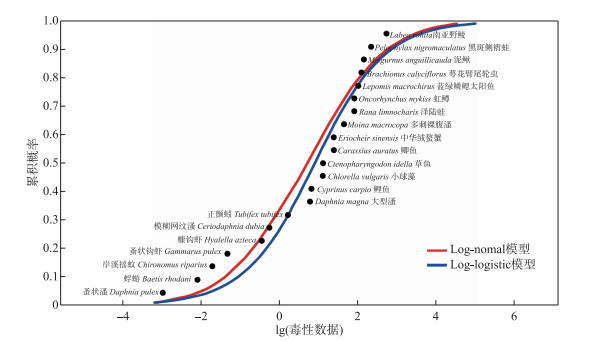
2.2 IMI的水质基准推导本研究分别通过Log-normal和Log-logistic模型,对36个水生生物物种的毒性数据进行拟合及分析,得到基于急性毒性的物种敏感度分布曲线,如图 1所示。经A-D检验,收集的21个急性毒性数据和15个慢性数据的对数值均满足正态分布,可用于SSD的构建和水质基准的推导。以毒性数据的对数值为横坐标,累积概率值为纵坐标绘制SSD曲线,通过SSDToolbox软件中多种非线性函数模型对处理后的数据进行拟合,得到了相应拟合曲线,其中Log-normal和Log-logistic两种模型均具有较好的拟合,拟合图形如图 1所示。结合急性毒性数据模型拟合评价参数(表 3),Log-normal模型的AIC值较Log-logistic模型小,故Log-normal模型对急性毒性数据的拟合结果更好,选择该模型数据推导水质基准值,其中HC5值为0.0139 mg/L。HC5值也反映了淡水生物对IMI浓度的敏感性差异,HC5值越小说明淡水生物对IMI浓度的变化越敏感,越容易受到影响。在所收集的物种中,蜉蝣(Baetis rhodani)和蚤状溞(Daphnia pulex)在HC5条件下会受到影响。IMI的HC5值无法保护目前已知的所有水生生物。依据水质基准推导公式,AF取值2,则IMI的SWQC值为6.95 μg/L。
|
图 1 吡虫啉的急性物种敏感度分布曲线 Fig.1 The acute species sensitivity distribution curves for IMI |
| 表 3 吡虫啉的急性和慢性SSD拟合结果* Tab. 3 Summary of fitting data with acute and chronic species sensitivity distribution of IMI |
利用SSDToolbox软件中的非线性函数模型拟15个慢性毒性数据,得到了相应拟合曲线,其中Log-normal和Log-logistic两种模型拟合较好,拟合图形如图 2所示。结合慢性毒性数据模型拟合评价参数(表 3),Log-normal模型的AIC值较Log-logistic模型小,故该模型对慢性毒性数据的拟合结果最好,选择该模型数据推导水质基准值,其中HC5值为0.0014 mg/L。慢性毒性测试条件下,伸展摇蚊对IMI最敏感,在此HC5值条件下会受到影响。为了保护已知的所有水生物,依据水质基准推导公式,AF取值3,则IMI的LWQC值为0.47 μg/L。

|
图 2 吡虫啉的慢性物种敏感度分布曲线 Fig.2 The chronic species sensitivity distribution curves for IMI |
本文采用SSD法推导IMI的淡水水质基准值,其中急性和慢性毒性数据均分别采用传统的Log-normal和Log-logistic模型进行拟合,依据AIC选取Log-normal模型作为最佳拟合模型,但不否认存在更高拟合度的函数模型,该问题需要国内外学者深入研究。不同地理区域生态系统的种群结构以及敏感物种有所差异,这会影响对水质基准与风险评估结果的分析。本研究所选取的水生生物均为本土生物,这使得推导的水质基准能有效地对我国水生环境提供保护,对本土化水质基准研究具有指导意义。
2.3 中国主要流域地表水中IMI的生态风险评估通过收集文献数据,共获得2016—2019年的长江、黄河和鸭绿江等16条河流不同季节的IMI水环境浓度数据,同时获得了太湖、洞庭湖和鄱阳湖3大湖泊的IMI水环境浓度数据。所获得的环境浓度数据均为测得的浓度均值。上述研究区地表水中IMI的含量变化范围不大,介于1.06~81.1 ng/L之间。16条河流和3大湖泊中IMI的最大检出浓度均低于短期水质基准值和长期水质基准值,根据RQ法计算各地水体的风险商,结果如表 4所示,表明地表水中的IMI对淡水生物有不同程度的影响。1个流域(鸭绿江)属于无风险状态,占比5.26%;15个流域(辽河、滦河、黄河、长江、钱塘江、岷江、嘉陵江、乌江、汉江、瓯江、晋江、松花江、太湖、洞庭湖、鄱阳湖)属于低风险状态,占比78.95%;另外3个流域(黄浦江、九龙江、珠江)属于中风险状态,占比15.79%。其中,中风险流域为黄浦江、九龙江和珠江,均为我国南部沿海河流。新烟碱类农药高污染情况主要发生在我国南方与该区域农业活动频繁和温暖湿润的气象条件有关。综上所述,我国南部沿海流域中IMI污染程度较大,对水生生物表现出较高的生态风险。
| 表 4 不同流域地表水中吡虫啉的生态风险商值 Tab. 4 Ecological risk quotients of IMI in different river basins |
尽管本研究的毒性数据筛选、水质基准值推导方法和生态风险评估过程均遵循我国指南文件,并参考前人研究,但仍然存在不确定性。首先,不同的毒性数据筛选原则可能导致不同的结果,而同种生物在不同地域的药物耐受性也可能存在差异,进而会影响基准值的推导结果。因此,后续计划将利用不同区域的本土物种进行实验,以验证毒性数据和基准推导的准确性。其次,IMI的淡水生物毒性可能受到水体pH、溶解有机质、温度等水质参数的影响,但目前的研究尚不能对这些因素的影响进行定量校正。此外,IMI的地表水环境暴露数据时间跨度为3年,因此具有时效性。为了更准确地描述IMI暴露并尽可能减少不确定性,还需要进一步的工作来获得更多不同时间和空间尺度上的IMI的暴露数据。特别地,为了综合评估全国地表水的风险情况,还需进一步搜集西北及西南地区IMI环境浓度的监测数据。
2.4 国内外研究比较以及水质基准值对我国新烟碱类农药污染物环境标准的启示国内外研究者对IMI的水质标准研究较少,仅有少量文献报导,故本文对国内外研究方法进行研究,并总结出精准的推导方法,以期获得高质量的IMI水质基准值。《地表水环境质量标准》 (GB 3838—2002)尚未规定IMI的标准限值,因此需要将本文推导的基准值与其他国家或地区的标准限值进行比较。与本研究通过SSD法推导的IMI长期水质基准值0.47 μg/L相比,欧盟、新西兰及其他已报道文献中的标准限值较低(表 5)。本研究结果与其他国家或地区的标准值存在一定差异,这是由于我国与其他国家的地理环境存在差异,同时敏感物种也存在差异。SSD推导水质基准的关键在于利用本地或特定地点的数据,而当使用澳大利亚和非澳大利亚物种拟合SSD曲线时,研究结果显示存在差异。实验室SSD曲线与当地围隔实验和野外监测数据的比较也证实了这一观点[17]。武江越等[50]研究表明,本土和非本土物种的敏感性分布具有较低的一致性。因此,在推导我国本土荧蒽水生生物基准时,不能简单地利用国外水生生物毒性数据。此外,还有研究表明,使用美国淡水生物物种推导的生态风险阈值时,可能会导致我国淡水生物中的所有物种遭受“欠保护”的风险[51]。
| 表 5 不同地区和国家的吡虫啉水质标准 Tab. 5 Water quality criteria of IMI in different countries and regions |
国家间基准值的差异源于其推导方法和数据来源的差异。欧盟根据本土水质特点制定相关基准指南。新西兰的水质基准是通过SSD法推导得出的,该国建议采用高、中、低可靠性触发值来全面保护生物安全。即使使用同种的推导方法,各国的气候、地貌、水文等因素也会影响水生生物毒性实验数据值,最终影响水质基准推导的结果。经分析,范丹丹等[20]在构建SSD时,由于收集了国外的物种毒性实验数据,故推导的基准值可能并不能很好地反映我国水体环境的实际情况。该研究选取了多种非本地物种作为研究对象,包括日本青鳉(Oryzias latipes)、南美慈鲷鱼(Cichlidae)、罗洛斯锈斑螯虾(Faxonius rusticus)和尼罗罗非鱼(Oreochromis niloticus)等,这些物种对IMI敏感,日本青鳉是此研究中对IMI第三敏感的物种,尼罗罗非鱼已被列入中国淡水外来入侵物种名录,这也是导致其水质基准偏低的原因。
根据本研究推导的IMI水质基准值,可为我国制定IMI标准限值提供参考,建议该标准限值为0.47 μg/L。
3 结论1) 本研究利用本土淡水水生生物构建SSD推导了IMI的水质标准,即SWQC和LWQC值分别为6.95和0.47 μg/L。
2) 随着我国水质基准的不断完善,有关部门应根据我国本土物种和水环境生态系统特点,构建符合我国国情的淡水水生生物水质基准体系。由于我国地表水环境质量标准中缺乏有关IMI的标准限值,因此可以参考本研究推导的LWQC值0.47 μg/L,制定相应的标准限制值。
3) 总体而言,我国地表水环境中IMI导致的生态风险较低。但我国南部沿海河流受IMI影响较为严重,因此建议对我国南部沿海流域进行重点治理,并加强对该区域IMI使用的管理。
| [1] |
Zhang Q, Zhao C, Lu XX et al. Advances in research on toxic effects of neonicotinoid insecticides on non-target organisms. Asian Journal of Ecotoxicology, 2020, 15(1): 56-71. [张琪, 赵成, 卢晓霞等. 新烟碱类杀虫剂对非靶标生物毒性效应的研究进展. 生态毒理学报, 2020, 15(1): 56-71.] |
| [2] |
Zhang C, Tian D, Yi XH et al. Occurrence, distribution and seasonal variation of five neonicotinoid insecticides in surface water and sediment of the Pearl Rivers, South China. Chemosphere, 2019, 217: 437-446. DOI:10.1016/j.chemosphere.2018.11.024 |
| [3] |
Wang L, Deng YH, Luo Y et al. Occurrence and risk assessment of typical neonicotinoid pesticides in Lake Poyang Basin. J Lake Sci, 2023, 35(3): 909-921. [王磊, 邓洋慧, 罗莹等. 鄱阳湖流域典型新烟碱类杀虫剂的污染特征和风险评估. 湖泊科学, 2023, 35(3): 909-921. DOI:10.18307/2023.0331] |
| [4] |
Neury-Ormanni J, Vedrenne J, Morin S. Benthic diatom growth kinetics under combined pressures of microalgal competition, predation and chemical stressors. Science of the Total Environment, 2020, 734: 139484. DOI:10.1016/j.scitotenv.2020.139484 |
| [5] |
Sánchez-Bayo F, Goka K. Influence of light in acute toxicity bioassays of imidacloprid and zinc pyrithione to zooplankton crustaceans. Aquatic Toxicology, 2006, 78(3): 262-271. DOI:10.1016/j.aquatox.2006.03.009 |
| [6] |
Feng SL, Kong ZM, Wang XM et al. Acute toxicity and genotoxicity of two novel pesticides on amphibian, Rana N. Hallowell. Chemosphere, 2004, 56(5): 457-463. DOI:10.1016/j.chemosphere.2004.02.010 |
| [7] |
Gradila M. Chronic aspects of imidacloprid on the fishes from Cyprinidae family. Romanian Journal of Plant Protection, 2013, 6: 11-15. |
| [8] |
Hassoon HA, Salman SA. The acute effect of pesticides carbaryl and imidacloprid on Daphnia pulex species. Journal of International Environmental Application and Science, 2016, 11(1): 18-25. |
| [9] |
Hong YH, Huang Y, Wu S et al. Effects of imidacloprid on the oxidative stress, detoxification and gut microbiota of Chinese mitten crab, Eriocheir sinensis. Science of the Total Environment, 2020, 729: 138276. DOI:10.1016/j.scitotenv.2020.138276 |
| [10] |
Si JY, Hong YJ, Xia P et al. Water quality criteria/standards and ecological risk assessment of oxytetracycline for freshwater organisms in China. Research of Environmental Sciences, 2023, 36(2): 403-413. [司静宜, 洪亚军, 夏鹏等. 我国土霉素的淡水生物水质基准与标准及生态风险评估研究. 环境科学研究, 2023, 36(2): 403-413.] |
| [11] |
Kong XZ, He W, Qin N et al. Assessing acute ecological risks of heavy metals to freshwater organisms by species sensitivity distributions. China Environmental Science, 2011, 31(9): 1555-1562. [孔祥臻, 何伟, 秦宁等. 重金属对淡水生物生态风险的物种敏感性分布评估. 中国环境科学, 2011, 31(9): 1555-1562.] |
| [12] |
中华人民共和国环境保护部. 淡水水生生物水质基准制定技术指南: HJ 831—2017. 北京: 中国环境出版社, 2017.
|
| [13] |
中华人民共和国生态环境部. 淡水水生生物水质基准制定指南(修订征求意见稿): HJ 831—2022. 北京: 中国环境出版社, 2022.
|
| [14] |
Zheng YT, Gao ZJ, Yu Y et al. Derivation of predicted no effect concentrations for methyl tert-butyl ether using species sensitivity distributions on aquatic organisms. Asian Journal of Ecotoxicology, 2022, 17(2): 372-380. [郑玉婷, 高子竣, 于洋等. 基于物种敏感度分布法的甲基叔丁基醚水生生物预测无效应浓度推导. 生态毒理学报, 2022, 17(2): 372-380.] |
| [15] |
Jin XW, Zha JM, Xu YP et al. Derivation of aquatic predicted no-effect concentration (PNEC) for 2, 4-dichlorophenol: Comparing native species data with non-native species data. Chemosphere, 2011, 84(10): 1506-1511. DOI:10.1016/j.chemosphere.2011.04.033 |
| [16] |
Jin XW, Zha JM, Xu YP et al. Toxicity of pentachlorophenol to native aquatic species in the Yangtze River. Environmental Science and Pollution Research, 2012, 19(3): 609-618. DOI:10.1007/s11356-011-0594-1 |
| [17] |
Hose GC, Van den Brink PJ. Confirming the species-sensitivity distribution concept for endosulfan using laboratory, mesocosm, and field data. Archives of Environmental Contamination and Toxicology, 2004, 47(4): 511-520. DOI:10.1007/s00244-003-3212-5 |
| [18] |
Stehle S, Schulz R. Agricultural insecticides threaten surface waters at the global scale. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(18): 5750-5755. DOI:10.1073/pnas.1500232112 |
| [19] |
Smit CE, Posthuma-Doodeman CJAM, van Vlaardingen PLA et al. Ecotoxicity of imidacloprid to aquatic organisms: Derivation of water quality standards for peak and long-term exposure. Human and Ecological Risk Assessment: An International Journal, 2015, 21(6): 1608-1630. DOI:10.1080/10807039.2014.964071 |
| [20] |
Fan DD, Liu HL, Yang LY. Neonicotinoid insecticides threaten surface waters at the national scale in China. Environmental Science, 2022, 43(6): 2987-2995. [范丹丹, 刘红玲, 杨柳燕. 我国地表水新烟碱类杀虫剂对水生生物安全的威胁. 环境科学, 2022, 43(6): 2987-2995. DOI:10.13227/j.hjkx.202109064] |
| [21] |
Liu N, Jin XW, Feng CL et al. Ecological risk assessment of fifty pharmaceuticals and personal care products (PPCPs) in Chinese surface waters: A proposed multiple-level system. Environment International, 2020, 136: 105454. DOI:10.1016/j.envint.2019.105454 |
| [22] |
Lekvongphiboon P, Praphairaksit N. Combined toxicity of imidacloprid and cadmium on histopathology and acetylcholinesterase activity in aquatic oligochaetes (Tubifex tubifex Muller, 1774). Environmental Geochemistry and Health, 2020, 42(10): 3431-3441. DOI:10.1007/s10653-020-00585-4 |
| [23] |
U.S. Environmental Protection Agency. Pesticide ecotoxicity database (Formerly: Environmental effects database (EEDB)). Washington: Environmental Fate and Effects Division, 1992.
|
| [24] |
Qadir S, Latif A, Ali M et al. Effects of imidacloprid on the hematological and serum biochemical profile of Labeo rohita. Pakistan Journal of Zoology, 2014, 46(4): 1085-1090. |
| [25] |
Xia XH, Xia XP, Huo WR et al. Toxic effects of imidacloprid on adult loach (Misgurnus anguillicaudatus). Environmental Toxicology and Pharmacology, 2016, 45: 132-139. DOI:10.1016/j.etap.2016.05.030 |
| [26] |
Beketov MA, Liess M. Potential of 11 pesticides to initiate downstream drift of stream macroinvertebrates. Archives of Environmental Contamination and Toxicology, 2008, 55(2): 247-253. DOI:10.1007/s00244-007-9104-3 |
| [27] |
Van den Brink PJ, VanSmeden JM, Bekele RS et al. Acute and chronic toxicity of neonicotinoids to nymphs of a mayfly species and some notes on seasonal differences. Environmental Toxicology and Chemistry, 2016, 35(1): 128-133. DOI:10.1002/etc.3152 |
| [28] |
Raby M, Maloney E, Poirier DG et al. Acute effects of binary mixtures of imidacloprid and tebuconazole on 4 freshwater invertebrates. Environmental Toxicology and Chemistry, 2019, 38(5): 1093-1103. DOI:10.1002/etc.4386 |
| [29] |
Hayasaka D, Korenaga T, Suzuki K et al. Differences in susceptibility of five cladoceran species to two systemic insecticides, imidacloprid and fipronil. Ecotoxicology, 2012, 21(2): 421-427. DOI:10.1007/s10646-011-0802-2 |
| [30] |
Azevedo-Pereira HMVS, Lemos MFL, Soares AMVM. Behaviour and growth of Chironomus riparius Meigen (Diptera: Chironomidae) under imidacloprid pulse and constant exposure scenarios. Water, Air, & Soil Pollution, 2011, 219(1): 215-224. DOI:10.1007/s11270-010-0700-x |
| [31] |
Gharaei A, Karimi M, Mirdar J et al. Population growth of Brachionus calyciflorus affected by deltamethrin and imidacloprid insecticides. Iranian Journal of Fisheries Sciences, 2020, 19: 588-601. DOI:10.22092/IJFS.2018.117180 |
| [32] |
Adochite C, Andronic L. Toxicity of a binary mixture of TiO2 and imidacloprid applied to Chlorella vulgaris. International Journal of Environmental Research and Public Health, 2021, 18(15). DOI:10.3390/ijerph18157785 |
| [33] |
Topal A, Alak G, Ozkaraca M et al. Neurotoxic responses in brain tissues of rainbow trout exposed to imidacloprid pesticide: Assessment of 8-hydroxy-2-deoxyguanosine activity, oxidative stress and acetylcholinesterase activity. Chemosphere, 2017, 175: 186-191. DOI:10.1016/j.chemosphere.2017.02.047 |
| [34] |
Tian X, Hong XS, Yan SH et al. Neonicotinoids caused oxidative stress and DNA damage in juvenile Chinese rare minnows (Gobiocypris rarus). Ecotoxicology and Environmental Safety, 2020, 197: 110566. DOI:10.1016/j.ecoenv.2020.110566 |
| [35] |
Ade CM, Boone MD, Puglis HJ. Effects of an insecticide and potential predators on green frogs and northern cricket frogs. Journal of Herpetology, 2010, 44(4): 591-600. DOI:10.1670/09-140.1 |
| [36] |
Butcherine P, Kelaher BP, Taylor MD et al. Impact of imidacloprid on the nutritional quality of adult black tiger shrimp (Penaeus monodon). Ecotoxicology and Environmental Safety, 2020, 198: 110682. DOI:10.1016/j.ecoenv.2020.110682 |
| [37] |
Roessink I, Merga LB, Zweers HJ et al. The neonicotinoid imidacloprid shows high chronic toxicity to mayfly nymphs. Environmental Toxicology and Chemistry, 2013, 32(5): 1096-1100. DOI:10.1002/etc.2201 |
| [38] |
Raby M, Zhao XM, Hao CY et al. Relative chronic sensitivity of neonicotinoid insecticides to Ceriodaphnia dubia and Daphnia magna. Ecotoxicology and Environmental Safety, 2018, 163: 238-244. DOI:10.1016/j.ecoenv.2018.07.086 |
| [39] |
Scherer C, Wolf R, Völker J et al. Toxicity of microplastics and natural particles in the freshwater dipteran Chironomus riparius: Same same but different?. Science of the Total Environment, 2020, 711: 134604. DOI:10.1016/j.scitotenv.2019.134604 |
| [40] |
Raby M, Zhao XM, Hao CY et al. Chronic toxicity of 6 neonicotinoid insecticides to Chironomus dilutus and Neocloeon triangulifer. Environmental Toxicology and Chemistry, 2018, 37(10): 2727-2739. DOI:10.1002/etc.4234 |
| [41] |
Shan Y, Yan SH, Hong XS et al. Effect of imidacloprid on the behavior, antioxidant system, multixenobiotic resistance, and histopathology of Asian freshwater clams (Corbicula fluminea). Aquatic Toxicology, 2020, 218: 105333. DOI:10.1016/j.aquatox.2019.105333 |
| [42] |
Schrama M, Barmentlo SH, Hunting ER et al. Pressure-induced shifts in trophic linkages in a simplified aquatic food web. Frontiers in Environmental Science, 2017, 5: 75. DOI:10.3389/fenvs.2017.00075 |
| [43] |
Chen YC, Zang L, Liu MD et al. Ecological risk assessment of the increasing use of the neonicotinoid insecticides along the east coast of China. Environment International, 2019, 127: 550-557. DOI:10.1016/j.envint.2019.04.010 |
| [44] |
Lu CS, Lu ZB, Lin S et al. Neonicotinoid insecticides in the drinking water system-Fate, transportation, and their contributions to the overall dietary risks. Environmental Pollution, 2020, 258: 113722. DOI:10.1016/j.envpol.2019.113722 |
| [45] |
Chen YC, Zang L, Shen GF et al. Resolution of the ongoing challenge of estimating nonpoint source neonicotinoid pollution in the Yangtze River Basin using a modified mass balance approach. Environmental Science Technology, 2019, 53(5): 2539-2548. DOI:10.1021/acs.est.8b06096 |
| [46] |
Wan YJ, Wang Y, Xia W. Neonicotinoids in raw, finished, and tap water from Wuhan, Central China: Assessment of human exposure potential. Science of the Total Environment, 2019, 675: 513-519. DOI:10.1016/j.scitotenv.2019.04.267 |
| [47] |
Xiong JJ, Wang Z, Ma X et al. Occurrence and risk of neonicotinoid insecticides in surface water in a rapidly developing region: Application of polar organic chemical integrative samplers. Science of the Total Environment, 2019, 648: 1305-1312. DOI:10.1016/j.scitotenv.2018.08.256 |
| [48] |
Liu ZK, Cui S, Zhang LM et al. Occurrence, variations, and risk assessment of neonicotinoid insecticides in Harbin section of the Songhua River, northeast China. Environmental Science and Ecotechnology, 2021, 8: 100128. DOI:10.1016/j.ese.2021.100128 |
| [49] |
Zhou YT, Wu JX, Wang B et al. Occurrence, source and ecotoxicological risk assessment of pesticides in surface water of Wujin District (northwest of Taihu Lake), China. Environmental Pollution, 2020, 265: 114953. DOI:10.1016/j.envpol.2020.114953 |
| [50] |
Wu JY, Guo XM, Cui W et al. Development of native aquatic life water quality criteria for fluoranthene in China. Environmental Chemistry, 2023, 42(3): 855-862. [武江越, 郭晓敏, 崔嵬等. 中国本土水生生物荧蒽水质基准研究. 环境化学, 2023, 42(3): 855-862.] |
| [51] |
Li HX, Zhang RQ, Wu FC et al. Comparison of mercury species sensitivity distributions of freshwater biota in China and the United States. Acta Scientiae Circumstantiae, 2012, 32(5): 1183-1191. [李会仙, 张瑞卿, 吴丰昌等. 中美淡水生物区系中汞物种敏感度分布比较. 环境科学学报, 2012, 32(5): 1183-1191. DOI:10.13671/j.hjkxxb.2012.05.026] |
 2024, Vol. 36
2024, Vol. 36 

