(2: 水利部太湖流域水治理重点实验室, 无锡 214131)
(3: 江南大学环境与土木工程学院, 无锡 214000)
(4: 河海大学环境学院, 南京 210098)
(5: 河海大学港口海岸与近海工程学院, 南京 210098)
(2: Key Laboratory of Taihu Basin Water Resources Management and Protection of the Ministry of Water Resources, Wuxi 214131, P. R. China)
(3: College of Environment and Civil Engineering, Jiangnan University, Wuxi 214000, P. R. China)
(4: College of Environment, Hohai University, Nanjing 210098, P. R. China)
(5: College of Harbour, Coastal and Offshore Engineering, Hohai University, Nanjing 210098, P. R. China)
湖泊是重要的地表水承载体及饮用水资源库[1]。近年来,湖泊水体富营养化引起的蓝藻水华暴发导致了一系列水质问题[2],引起国内外学者的广泛关注。蓝藻水华的出现不仅降低水体水质影响城市供水,而且丝状蓝藻产生的以2-甲基异莰醇(2-methylisoborneol,2-MIB)为主的嗅味物质严重威胁水生态安全和水资源质量[3]。2-MIB是一种土霉味的萜类化合物,嗅味阈值较低(< 10 ng/L)且传统水处理工艺难以去除[3-4],它不仅使水体散发难闻的异味,增加水厂处理成本,还会富集在鱼类等水产品中影响其使用价值[5-6]。湖泊水体2-MIB主要归因于丝状蓝藻的生长代谢,如假鱼腥藻、颤藻、拟浮丝藻和束丝藻等,其中以假鱼腥藻代谢引发的2-MIB嗅味问题最多[7-8]。Izaguirre等[9]对美国卡斯泰克湖的研究最早发现假鱼腥藻是2-MIB的主要来源,Su等[10]对密云水库的嗅味调查发现颤藻是2-MIB的主要贡献者,Wu等[11]对天目湖水库2-MIB的研究又发现束丝藻是主要产2-MIB蓝藻。从前人研究结果来看,不同地区2-MIB来源有所不同,有必要寻找目标区域2-MIB的主要生产者以从源头上解决湖泊水体嗅味问题。
识别2-MIB来源最初常用蓝藻显微镜镜检,但后续研究发现产2-MIB蓝藻具有菌株特异性,同一藻种下产2-MIB和不产2-MIB的蓝藻时常共存,且难以从形态学上清楚区分[4],无法精准判断藻种是否产生2-MIB。为克服传统镜检方法的不足,随着2-MIB生物合成路径中相关基因的发现,实时荧光定量PCR技术(qPCR)定量2-MIB环化酶(mic)基因逐步发展成为一种评估2-MIB产生与否的精准高效替代技术[12]。蓝藻合成2-MIB涉及两个关键反应:先通过S-腺苷甲硫氨酸依赖性甲基转移酶(geranyl diphosphate 2-methyltransferase,GPPMT)将前体物质香叶基焦磷酸(geranyl diphosphate,GPP)转化为2-甲基-GPP,再通过2-MIB环化酶(2-MIB cyclase,mic)将2-甲基-GPP环化为2-MIB[13]。mic基因作为2-MIB操纵子的一部分,对2-MIB合成至关重要[4, 14],鉴定mic基因序列可以检测产2-MIB的特定物种[15],因此检测mic基因丰度和基因序列有助于准确辨别2-MIB来源。
产2-MIB蓝藻的生长和嗅味的产生受水文气象和营养盐等众多环境因子影响[15]。目前国内外该方面的研究对象主要为水库[16-19],而湖泊的相关研究十分有限。Wu等[11]研究发现天目湖水库2-MIB季节性动态变化易受短期水文气象过程干扰。Cao等[20]在青草沙水库的调查中发现光照强度是影响假鱼腥藻代谢2-MIB的主要因子。Wu等[21]在探究阳澄湖2-MIB的时空分布特征时,发现水温和氮磷比对水体2-MIB浓度的影响显著。从已有研究结果可以看出,影响2-MIB的环境因子众多,且不同环境条件下2-MIB的主导因素存在较大差异。
贡湖湾是太湖的重要组成部分,也是江苏无锡及苏州两市的重要水源地[22]。自2007无锡供水危机以来,太湖流域水环境综合治理工作不断推进,贡湖湾水环境状况得以显著改善[23]。然而受水文气象等不可控因素的影响,贡湖湾蓝藻水华仍时有发生,导致水源出现嗅味问题,威胁供水安全。本研究以太湖贡湖湾为研究对象,分析2022年3—12月及重点高温时段(7—9月)水体2-MIB变化特征,研究确定2-MIB的主要来源,探究2-MIB产生的影响因子,以期为贡湖湾水源地2-MIB防控提供指导。
1 材料与方法 1.1 采样点布设及样品采集为探究贡湖湾2-MIB时空变化特征,综合地形及生境差异性在贡湖湾望虞河入湖口、南部水域和北部水域布设4个站点(G1~G4)(图 1),于2022年3—12月开展逐月水质和2-MIB调查,其中在2-MIB高发期(2022年7—9月)增加藻类调查。为进一步研究高温时段贡湖湾2-MIB来源,在贡湖东北部水厂取水口附近布设1个站点(GH),于2022年7月29日-8月29日开展一周两次2-MIB及藻类的高频调查;同期为掌握产2-MIB蓝藻的时空分布特征,在贡湖湾均匀布设17个站点(S1~S17),同频次开展水质和藻类调查。文中风力和降雨数据取自贡湖湾附近的望亭自动监测站,太阳辐射数据来源于中国通量观测研究网络太湖站。
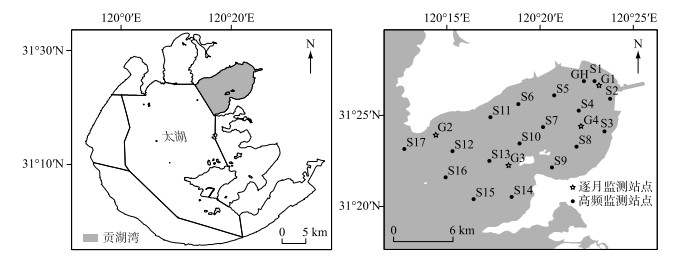
|
图 1 太湖贡湖湾监测点分布 Fig.1 Distribution of monitoring sites in Gonghu Bay of Lake Taihu |
采样过程中利用手机GPS工具箱准确定位,使用有机玻璃采水器采集水面以下0.5 m处混合水样5 L,用于常规水质指标检测。另外,现场每个采样点单独取40 mL水样装入挥发性有机物专用棕色瓶(安捷伦5183-4741)用于2-MIB分析测定,取1 L水样存于装有1% 鲁哥试剂的浮游植物专用瓶用于藻类鉴定,取500 mL水样冷藏保存于白色无菌瓶用于分子生物相关检测。待所有样品采集完成后,立即密封运回实验室进行各项指标的分析测定。
1.2 水质指标的测定 1.2.1 常规理化指标测定水温(WT)、pH、溶解氧(DO)等指标采用多功能水质参数仪原位测定,水体透明度(SD)用塞氏盘现场测定。总氮(TN)采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012)测定,氨氮(NH3-N)采用纳氏试剂分光光度法(HJ 535—2009)测定,硝酸盐氮(NO3--N)采用离子色谱法(HJ 84—2016)测定,总磷(TP)、溶解性总磷(DTP)和磷酸盐(PO43--P)采用钼酸铵分光光度法(GB 11893—1989)测定,五日生化需氧量(BOD5)采用稀释与接种法(HJ 505—2009)测定,高锰酸盐指数(CODMn)采用酸性高锰酸盐指数法(GB 11892—1989)测定,叶绿素a(Chl.a)采用丙酮萃取分光光度法(SL 88—2012)测定,总悬浮颗粒物(SS)采用重量法(GB11901—1989)测定。
1.2.2 2-MIB测定参照《生活饮用水臭味物质土臭素与2-甲基异莰醇检测方法》(GB/T 32470—2016),采用顶空固相微萃取-气相色谱-质谱法(HSPME-GCMS)定量分析测定。具体操作步骤如下:在20 mL的棕色顶空瓶中加入3.5 g氯化钠和小型磁力搅拌子加速水体中2-MIB的挥发溶出,加入10 mL样品溶液和10 μL内标物2-异丁基-3-甲氧基吡嗪,使用具有聚四氟乙烯涂层的硅胶垫密封。恒温磁力搅拌器温度为65℃,待溶液中氯化钠完全溶解后进行顶空吸附萃取。萃取30 min后,将HSPME取针头插入气相色谱进样口,在250℃下解析5 min,使用Agilent7890A-5975C气质联用仪进行检测分析。分析条件:载气为高纯氦气,恒流1 mL/min;进样口温度为250℃;进样方式为不分流进样;程序升温是60℃保持2 min,以8℃/min的速率升温至240℃(保持2 min);传输线温度为280℃;离子源温度为230℃;电子轰击能量70 eV;色谱柱使用Agilent HP-5MS(30 m×250 μm×0.25 μm);定量模式为SIM模式;定量离子为95。将2-甲基异莰醇标准溶液稀释至指定浓度,即10、20、50、70、80和100 ng/L,测定并构建标准曲线,方程为y=0.424x-0.235(x为含量比,y为2-MIB响应比),决定系数(R2)为0.999,线性关系良好。采用该方法对水体2-MIB进行检测,检出限为2.20 ng/L,加标回收率为97.6% ±5.1%,可以精准定量。
1.3 浮游植物定量分析用于浮游植物鉴定的水样经终浓度为1% 的鲁哥试剂现场固定后,室内静置沉淀48 h,通过虹吸管抽去多余的上清液,经沉淀后浓缩至30 mL。进行浮游植物定量分析时,将浓缩样品充分摇匀,吸取0.1 mL滴于浮游植物计数框中,使用显微镜(徕卡DM1000)在10×40倍下观察,主要依据《中国常见淡水浮游藻类图谱》及0.1 mL计数框-显微镜计数法(HJ1216—2021)进行浮游植物种类鉴定和计数。
1.4 mic基因的测定 1.4.1 实时荧光定量PCR绝对定量分析300 mL混合水样用真空泵经过0.45 μm醋酸纤维滤膜过滤,抽滤后富集藻类的滤膜使用FastDNAⓇ Spin Kit for Soil试剂盒(MP Biomedicals,美国)进行DNA提取,最后得到100 μL DNA提取液,置于-20℃保存。提取完成后使用Nano300紫外分光光度计(奥盛,杭州)测定DNA的浓度及纯度,OD260/OD280在1.8~2.0之间认为可供后续实验使用,不在此范围需进一步纯化。
将提取的DNA进行普通PCR扩增,扩增后的PCR产物进行琼脂糖凝胶电泳,切下目的条带后使用琼脂糖凝胶DNA回收试剂盒(天根,北京)纯化回收,将纯化后的产物与pMDTM19-T克隆载体(Takara,日本)连接,并在无菌环境下导入大肠杆菌DH5α感受态细胞(Takara,日本)中,于LB液体培养基中以120转/min的转速37℃振荡培养30 min,离心收集菌液,吸取适量已转化的感受态细胞涂布在含有Amp的LB固体培养基中过夜培养,次日挑选单菌落进行菌检PCR,检测到阳性克隆后将菌液加入适量含有Amp的LB液体培养基,以120转/min的转速37℃扩大培养过夜,将新鲜菌液送出测序。利用质粒提取试剂盒(天根,北京)提取质粒,使用Nano300紫外分光光度计测定质粒标准品的浓度,按照文献中公式计算质粒标准品拷贝数,将得到的质粒标准品按照其拷贝数依次进行10倍梯度稀释构建标准曲线。本研究合成的mic基因质粒标准品拷贝数为1.58×109 copies/μL,将稀释后终浓度为15.8~1.58×109 copies/μL的质粒标准品进行定量PCR扩增,每个浓度进行3次重复,基于质粒拷贝数(Cg)和循环阈值(Cq)构建标准曲线。建立的标准曲线方程为Cq=-3.313lg Cg+38.26,R2为0.9981,扩增效率为100.37%,检测下限为1.58×102 copies/μL,3次重复的Cq值标准差均小于0.2。
普通PCR反应体系为50 μL,其中含有2×Taq Plus Master Mix(康为世纪,北京)25 μL,上下游引物MIBQSF和MIBQSR各2 μL,DNA模板5 μL,ddH2O补足50 μL。普通PCR反应在Biometra Twin PCR仪中进行,扩增程序如下:94℃预变性2 min,94℃变性30 s,56℃退火30 s,72℃延伸15 s,35个循环。普通PCR反应体系各组分用量是菌检PCR反应的5倍,扩增条件与菌检PCR反应一致。定量PCR反应体系为25 μL,其中含有TB GreenⓇ Premix Ex TaqTM Ⅱ(Takara,日本)12.5 μL,上下游引物MIBQSF和MIBQSR各0.5 μL,DNA模板2 μL,ddH2O补足25 μL。定量PCR反应在Bio-rad CFX Connet中进行,mic基因扩增程序如下:95℃预变性30 s,95℃变性5 s,56℃退火15 s,72℃延伸15 s,40个循环。其中引物选用MIBQSF:5′-GACAGCTTCTACACCTCCATGA-3′和MIBQSR:5′-CAATCTGTAGCACCATGTTGAC-3′[24]。此引物能够扩增之前研究中无法扩增的mic基因序列,较其他引物而言适用性更强。
1.4.2 高通量测序定性分析将DNA提取液取出一部分送至上海凌恩生物科技有限公司进行mic基因的高通量测序。测序平台采用IlluminaPE250,测序引物与PCR反应引物一致,测序结果比对数据库选用NCBI数据库。
1.5 数据分析本研究利用ArcGIS 10.6、Origin 2023、R 4.3.0和IBM SPSS 26软件进行所有数据的处理分析及绘图。为了解2-MIB时空变化特征,将逐月2-MIB数据使用Kruskal-Wails非参数检验进行差异性分析。为探究2-MIB和产嗅藻的主要影响因子,研究首先通过相关性分析筛选出与2-MIB和产嗅藻密切相关的因子,再将这些因子分别与2-MIB和产嗅藻进行主成分分析,识别出贡献量最大的环境因子。主成分分析采用R 4.3.0中的psych包进行KMO和Bartlett检验,结果显示KMO值(分别为0.71和0.51,均大于0.5)和P值(P < 0.05)均满足主成分分析要求,而后利用procomp函数、ggplot2包和factoextra包进行分析和可视化。文中采样点示意图和拟浮丝藻空间分布图由ArcGIS 10.6制作,主成分分析图由R 4.3.0绘制,其他图在Origin 2023中完成。
2 结果 2.1 贡湖湾气象因子变化2022年3—12月,贡湖湾气象条件变化较大(表 1)。贡湖湾地区平均气温22.48℃,月均累积降雨量(P)为84.73 mm,4月最大为176.50 mm,11月最小为7.00 mm。月均太阳辐射(MSR)为88.15~288.69 W/m2,最高值出现在8月,最低值出现在12月。平均风速(WS)为1.75 m/s,主导风向季节差异显著,其中3—6月主导风向为东南风和南风,7—8月主导风向为南风和西北风,9—12月主导风向为东北风。
| 表 1 贡湖湾气象因子的时间变化 Tab. 1 Temporal variation of hydrological and meteorological factors in Gonghu Bay |
高温时段(7月29日-8月29日),贡湖湾地区高温少雨,平均气温为34.8℃,累计降雨天数为4天,累积降雨量为47.5 mm。平均风速为1.52 m/s,主导风向呈现东南风和西北风交替模式。日均太阳辐射(DSR)为43.50~325.91 W/m2,总体呈波动下降趋势,最高值出现在8月8日,最低值出现在8月27日。
2.2 贡湖湾水环境因子变化 2.2.1 逐月变化2022年3—12月,贡湖湾平均水温为21.9℃,8月高达32.9℃,12月最低为9.6℃。DO浓度在7.98~11.02 mg/L之间变化,均值为9.20 mg/L。TN与NO3--N浓度随时间变化总体先降后升,TN浓度变化范围为0.57~1.48 mg/L,均值为1.06 mg/L;NO3--N浓度变化范围为0.02~0.81 mg/L,均值为0.39 mg/L;NH3-N浓度在0.02~0.13 mg/L之间无规律波动(图 2a)。TP浓度变化规律与Chl.a和SS相似,表现出夏秋季高、冬春季低的特点(图 2b)。DTP和PO43--P浓度变化趋势一致,最低值均出现在6月(图 2b)。
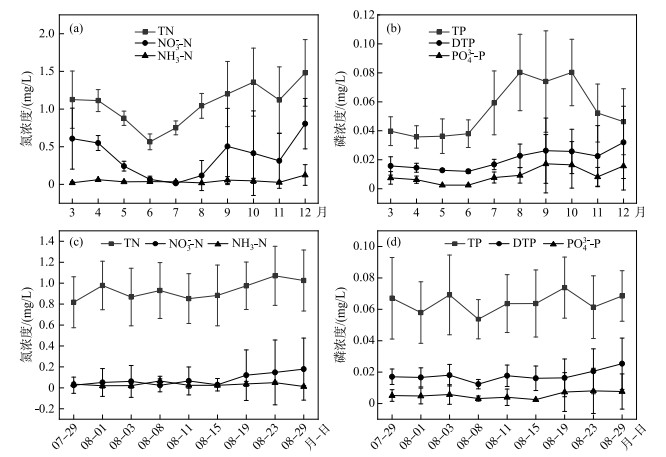
|
图 2 贡湖湾主要理化因子的逐月(a和b)和高温时段(c和d)变化 Fig.2 Seasonal (a and b) and high temperature period (c and d) changes of main physical and chemical factors in Gonghu Bay |
高温时段,贡湖湾水温总体呈先上升后下降的趋势,最高值出现在8月15日,为34.3℃,最低值出现在8月29日,为29.3℃。pH总体变化趋势与水温相反,最高值出现在8月23日,为8.87,最低值出现在8月3日,为8.62。TN浓度在0.82~1.07 mg/L之间变化,均值为0.93 mg/L(图 2c)。NO3--N和NH3-N浓度分别在0.02~0.18和0.02~0.12 mg/L之间变化(图 2c)。TP浓度在0.06 mg/L上下波动(图 2d)。DTP和PO43--P浓度随时间推移总体变化规律相似,平均值分别为0.018和0.005 mg/L(图 2d)。
2.3 贡湖湾2-MIB浓度变化 2.3.1 逐月变化逐月调查期间,贡湖湾2-MIB浓度范围为2.2~124.3 ng/L,平均浓度为21.7 ng/L。在时间上,2-MIB浓度整体呈先上升后下降的趋势,8月达到峰值,9月开始不断下降,最小值出现在12月(图 3a)。其中,8月2-MIB浓度显著高于5、11和12月(P < 0.05)。空间上,各采样点间无显著差异,2-MIB平均浓度基本无差别,G1和G2处2-MIB浓度变幅较大(图 3b)。

|
图 3 贡湖湾2-MIB浓度的时空变化 Fig.3 Temporal and spatial variation of 2-MIB concentration in Gonghu Bay |
高温时段的逐日监测结果表明,GH站点2-MIB浓度总体呈现出“双峰型”变化特征。其中,7月29日-8月1日2-MIB浓度迅速上升,于8月1日达到1385 ng/L,而后迅速下降并于8月3日降至90.7 ng/L;8月3—8日,2-MIB浓度维持较低水平,平均浓度为64.5 ng/L;8月11日2-MIB浓度又快速上升至357 ng/L,而后又于8月19日下降至100 ng/L,8月19—29日2-MIB浓度维持在109.3 ng/L左右(图 4)。
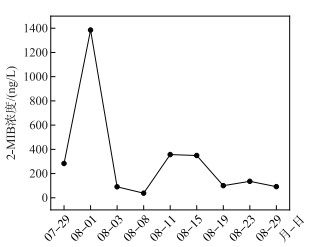
|
图 4 高温时段GH站点2-MIB浓度的时间变化 Fig.4 Temporal variation of 2-MIB concentration at GH site during high temperature period |
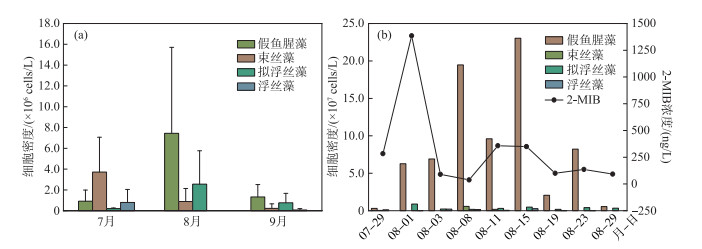
2022年7—9月,贡湖湾水体(G1~G4)共检出浮游植物6门48属,包括绿藻门25属、蓝藻门9属、硅藻门9属、隐藻门2属、甲藻门2属和裸藻门1属。贡湖湾浮游植物群落结构如图 5a所示,8月浮游植物密度最高,蓝藻为优势类群。在蓝藻门中,微囊藻密度所占比例最大(60.9%),为第一优势种,假鱼腥藻密度所占比例为28.0%,为第二优势种(图 5b)。另外,研究关注4种典型产2-MIB蓝藻的变化,分别为假鱼腥藻、拟浮丝藻、束丝藻和浮丝藻。产2-MIB蓝藻中假鱼腥藻和拟浮丝藻密度的最大值出现在8月,而束丝藻和浮丝藻密度的最大值出现在7月(图 6a)。相关性分析结果表明,4种产2-MIB蓝藻密度与2-MIB浓度之间均无显著相关性。
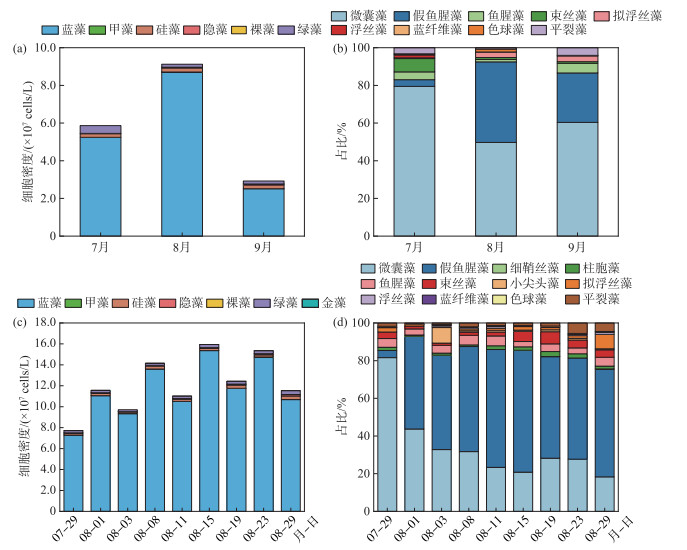
|
图 5 贡湖湾浮游植物及蓝藻组成变化 Fig.5 Composition changes of phytoplankton and cyanobacteria in Gonghu Bay |
|
图 6 贡湖湾典型产2-MIB蓝藻密度变化 Fig.6 Density variation of typical 2-MIB-producing cyanobacteria in Gonghu Bay |
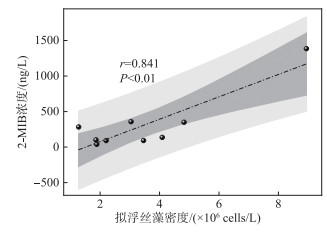
2022年7月29日-8月29日,贡湖湾水体(S1~S17)共检出浮游植物7门89属,包括绿藻门41属、硅藻门22属、蓝藻门12属、甲藻门4属、裸藻门4属、金藻门4属和隐藻门2属,其中蓝藻门占据主导地位(图 5c)。在蓝藻门中,7月29日贡湖湾优势种为微囊藻,随着时间变化假鱼腥藻密度增加,8月3日优势种从微囊藻演变为假鱼腥藻(图 5d)。另外,研究重点关注GH站点典型产2-MIB蓝藻的变化,发现假鱼腥藻处于绝对优势地位,贡献率为84.57%,其次是拟浮丝藻和束丝藻,分别占7.51% 和5.56%,浮丝藻占比最低,仅为2.38% (图 6b)。其中拟浮丝藻密度与2-MIB浓度呈现较好的一致性,具体表现为8月1日GH站点的2-MIB浓度为1385 ng/L,同期拟浮丝藻密度达到8.94×106 cells/L,为当日贡湖湾最高值;8月3日,GH站点的2-MIB浓度降低至90.7 ng/L,拟浮丝藻密度同步降低至2.20×106 cells/L;8月8日,GH站点的2-MIB浓度降低至38.2 ng/L,拟浮丝藻密度进一步降低至1.89×106 cells/L。与此同时,GH站点典型产2-MIB蓝藻密度与2-MIB浓度的相关性分析结果也显示,2-MIB浓度仅与拟浮丝藻密度呈极显著相关(r=0.841, P < 0.01)(图 7)。
|
图 7 GH站点拟浮丝藻密度与2-MIB浓度的相关性分析 Fig.7 Correlation analysis between density of Planktonthricoides and 2-MIB concentration at GH site |
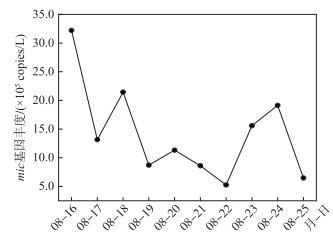
GH站点的qPCR结果显示,GH站点的mic基因拷贝数波动较大,波动范围为5.26×105~3.22×106 copies/L(图 8)。高通量测序结果发现,6种具有mic基因的蓝藻,分别为微鞘藻属(Microcoleus sp.)、泥泞颤藻(Oscillatoria limosa)、拟浮丝藻属(Planktothricoides sp.)、湖泊假鱼腥藻(Pseudanabaena limnetica)、假鱼腥藻种1(Pseudanabaena sp. dqh15)和假鱼腥藻种2(Pseudanabaena yagii)(表 2)。其中,拟浮丝藻占比最高,达99.43%;其次为假鱼腥藻,3种合计占比0.18%。根据mic基因拷贝数和6种产2-MIB蓝藻占比,两者相乘计算6种产2-MIB蓝藻的mic基因拷贝数,并将其与同时段2-MIB浓度进行相关性分析,结果发现6种产2-MIB蓝藻中拟浮丝藻mic基因拷贝数与2-MIB浓度之间相关性较强(r=0.743,P < 0.05)。
|
图 8 GH站点mic基因丰度变化 Fig.8 Variation of mic gene abundance at GH site |
| 表 2 GH站点含有mic基因蓝藻的组成及相对丰度 Tab. 2 Relative abundance of cyanobacteria containing mic gene at GH site |
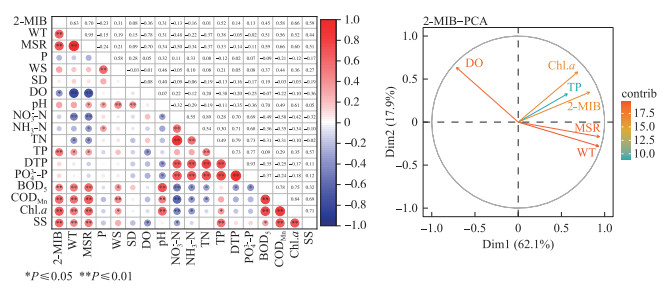
逐月调查期间,2-MIB与各环境因子的相关性分析结果表明,2-MIB与WT、MSR、TP、SS、BOD5、CODMn和Chl.a均呈极显著正相关(P < 0.01),与DO浓度呈显著负相关(P < 0.05)。其中,SS、BOD5、CODMn和Chl.a彼此间存在显著正相关,SS、BOD5、CODMn可视为Chl.a的被动因子,主成分分析中剔除SS、BOD5和CODMn。主成分分析结果显示,前两个主成分特征值均大于1,总方差贡献率为80.0%,可解释大部分变量。其中主成分1主要由WT、MSR、TP和2-MIB构成,其中WT和MSR贡献度较大;主成分2主要由DO和Chl.a构成(图 9)。
|
图 9 贡湖湾2-MIB相关性热图和主成分分析 Fig.9 Principal component analysis diagram and correlation heatmap of 2-MIB in Gonghu Bay |
高温时段,拟浮丝藻与各环境因子的相关性分析结果表明,拟浮丝藻与DTP呈显著正相关(P < 0.05),与WT呈显著负相关(P < 0.05),与DSR、NO3--N和微囊藻相关系数大于0.05。研究剔除其他因子,筛选出与拟浮丝藻密切相关的WT、DSR、NO3--N、DTP和微囊藻进行主成分分析,结果显示前两个主成分特征值大于1,可解释83.1% 的结果。其中主成分1主要由DSR、DTP、NO3--N、微囊藻和拟浮丝藻构成,DTP贡献度最大,主成分2主要由WT和DSR构成(图 10)。
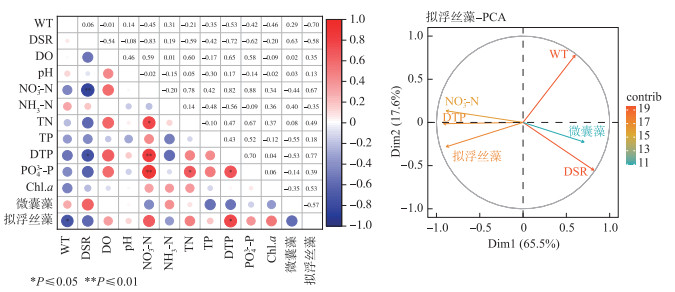
|
图 10 贡湖湾拟浮丝藻相关性热图和主成分分析 Fig.10 Principal component analysis diagram and correlation heatmap of Planktonthricoides in Gonghu Bay |
此外,研究发现高温时段拟浮丝藻的空间分布与监测日期前几日的主导风向有关。7月29—31日,贡湖湾主导风向为南风和东南风,使8月1日拟浮丝藻主要分布在GH站点附近;7月31日—8月1日,主导风向变为北风,导致聚集在GH站点附近的拟浮丝藻于8月2日向南扩散;8月5—6日,主导风向演变为西北风,进一步促使拟浮丝藻于8月7日向贡湖湾东南水域扩散(图 11和图 12)。
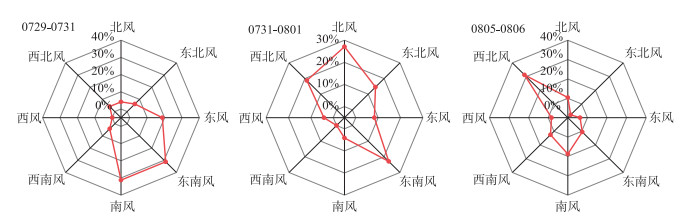
|
图 11 高温时段贡湖湾主导风向变化 Fig.11 Changes of dominant wind direction in Gonghu Bay during high temperature period |

|
图 12 高温时段贡湖湾拟浮丝藻的空间分布 Fig.12 Temporal and spatial variation of Planktonthricoides in Gonghu Bay during high temperature period |
迄今为止,国内外尚无研究对太湖贡湖湾2-MIB的来源做出明确解释。本次研究发现,尽管高温时段贡湖湾水体中丝状蓝藻主要为假鱼腥藻,但相关性分析结果显示,高温时段贡湖湾2-MIB浓度的变化仅与拟浮丝藻密度的变化呈现显著相关性。与此同时,基于mic基因的分子检测结果显示,贡湖湾水体具有mic基因的蓝藻中拟浮丝藻占比(99.43%)远高于假鱼腥藻等其他5种蓝藻,表明镜检下的大多数假鱼腥藻不含mic基因,从而不具备产2-MIB能力;而细胞密度相对较低的拟浮丝藻多数含有mic基因,能够代谢产生2-MIB。另外张琪等[25]研究发现,拟浮丝藻单个藻细胞总2-MIB含量(754~2549 fg/cell)远高于假鱼腥藻单个藻细胞总2-MIB含量(7~37 fg/cell),说明拟浮丝藻产嗅能力相对较强。而本研究具有mic基因的拟浮丝藻丰度(mic基因拷贝数)又与2-MIB浓度显著相关且相关性系数较高,进一步说明拟浮丝藻含有的mic基因在水环境中的表达水平较高[12],产2-MIB能力较强。综上所述,拟浮丝藻是高温时段贡湖湾2-MIB主要来源。
目前关于太湖2-MIB的研究甚少,已有研究认为颤藻和假鱼腥藻是太湖2-MIB的主要来源。Deng等[26]于2009年在研究太湖2-MIB与环境因子的相互关系时,发现颤藻对太湖水体结合态2-MIB贡献较大。Yang等[27]于2021年7—10月在东太湖藻型湖区和草型湖区布设9个点位开展2-MIB调查,研究结果表明假鱼腥藻代谢产生的2-MIB是水体嗅味的主要成因。同是针对太湖2-MIB的调查研究,本研究的2-MIB来源却与前人研究不同,原因可能有两个方面:一方面,考虑到同一藻种下产嗅和不产嗅的菌株时常共存,研究若仅通过相关性等数据分析的方法将藻类镜检和2-MIB数据进行处理,研究结果可能会出现“假相关”[28],不利于判别产2-MIB蓝藻种源。而本研究将丝状蓝藻镜检结果和2-MIB功能基因mic的数据结合分析,所得结果更为准确可靠;另一方面,Su等[29]针对青草沙水库2-MIB的连续研究发现,随着水体生境条件的变化,青草沙水库产2-MIB蓝藻由2013年的浮丝藻演替为2015年的假鱼腥藻。本研究中产2-MIB的拟浮丝藻多分布在温度较高的低纬度地区[30],2022年太湖流域持续高温[31],为拟浮丝藻大量生长繁殖创造了有利条件,可能导致太湖产2-MIB蓝藻种类发生演替。此外,太湖水域面积较大,不同湖湾生境条件差异也较大,不同湖湾产2-MIB的蓝藻种类可能有所不同。因此,有必要进一步加强太湖及不同湖湾产2-MIB蓝藻的调查研究。
3.2 2-MIB月变化的影响因子太湖贡湖湾2-MIB月变化差异显著,表现为夏季明显高于其他季节的变化规律,这与苏晓等[32]对水库2-MIB的研究结果相同。水体2-MIB月变化与水文气象过程的干扰和水环境条件的变化息息相关,但由于地理位置及气候条件的差异,不同区域影响2-MIB变化的因子各不相同[15, 33-34]。而本研究相关性分析和主成分分析则表明水温、月均太阳辐射、TP和Chl.a是影响贡湖湾2-MIB变化的关键因子,其中水温和月均太阳辐射对于2-MIB的影响发挥主导作用。
水温是驱动2-MIB月变化的首要因素,水温的升高有助于水体2-MIB浓度的增加[21]。本研究夏季(6—8月)水温为30.4℃,适宜产2-MIB蓝藻生长,水环境中的2-MIB浓度逐渐升高;进入秋季(9—11月),水温降至24.5℃,不适宜产2-MIB蓝藻生长,水体2-MIB浓度逐步降低;至冬季(12月)水温为9.6℃,2-MIB浓度达到最低值,说明夏季高温促进2-MIB的产生。月均太阳辐射是影响2-MIB季节变化的另一要素,太阳辐射强度的增加有利于增强产2-MIB蓝藻的光合作用[35]。本研究中夏季平均太阳辐射为242.5 W/m2,为整个调查期间最高,此时产2-MIB蓝藻获取充足的光照得以大量繁殖,使水体2-MIB浓度处于高位。由此可见,贡湖湾夏季水温及光照强度均处于较高水平,适宜的气候条件加快产2-MIB蓝藻的生长代谢,致使夏季贡湖湾水体2-MIB嗅味问题更加突出,与周君薇等[12]在太湖的研究结果一致。
湖泊富营养化也会影响水体2-MIB产生,因为水环境营养盐的变化影响蓝藻生长,进而影响水体2-MIB[19, 36]。Li等[37]在太湖嗅味物质的调查研究中发现TP显著影响水体2-MIB变化,而本研究结果同样显示TP浓度与2-MIB浓度呈极显著正相关。近年太湖治理成效显著,入湖污染负荷降低使水体氮、磷浓度总体呈下降趋势[38]。本研究中贡湖湾TN浓度最低值出现在夏季,此时氮素能够限制大多数浮游植物的生长[25],产2-MIB蓝藻因其常存于水柱亚表层,即使在氮限制的水环境下仍能够获取沉积物中释放的氮从而更具生长优势[15]。同时,夏季温度升高促使微生物生理活动加剧,底泥中磷酸盐释放至上覆水,贡湖湾水体中的TP呈上升趋势,有利于丝状蓝藻的生长及2-MIB产生[39]。此外,湖泊水体2-MIB的发生主要与丝状蓝藻增殖有关,丝状蓝藻的生理生长特性与微囊藻有相似之处,如好高温和喜静水等。现阶段太湖夏季蓝藻水华最为严重且优势种仍为微囊藻,因此研究中2-MIB浓度与Chl.a浓度呈显著正相关[26, 40]。
3.3 高温时段拟浮丝藻时空变化的影响因子拟浮丝藻是高温时段太湖贡湖湾水体2-MIB的主要来源,其时空变化能够直接反映水体2-MIB的时空变化。研究发现,高温时段贡湖湾拟浮丝藻的变化具有明显的时空异质性。相关性分析和主成分分析表明,拟浮丝藻的变化主要与水温、日均太阳辐射、NO3--N、DTP和微囊藻有关,其中水温、日均太阳辐射和DTP是主导影响因子。
水温和光照是拟浮丝藻生长和繁殖的重要因子。与其他产2-MIB蓝藻相比,拟浮丝藻耐受高温环境,但是当温度超过30℃时,温度的升高会使拟浮丝藻的生长速率降低,说明30℃是最适合拟浮丝藻生长的温度[30]。本研究高温时段贡湖湾平均水温为32.7℃,为近年来最高。高温时段前期,贡湖湾逐日水温均超过30℃,对拟浮丝藻的生长产生相对抑制作用,此时拟浮丝藻密度均值为2.2×106 cells/L;高温时段后期(8月23—29日),贡湖湾水温稳步降低,从34.3℃降至29.3℃,拟浮丝藻密度相应地从3.26×106 cells/L增加到1.08×107 cells/L,说明高温时段贡湖湾拟浮丝藻密度与水温呈反向变化,与前人研究论述一致[41]。另外研究还发现,拟浮丝藻对中等偏高光强环境具有较强耐受性,但过高的光强不利于其生长[30],本研究也得到类似结论。高温时段前期,贡湖湾的太阳辐射强度总体保持平稳,在318 W/m2上下波动,此期间拟浮丝藻变化也相对稳定;高温时段中后期,太阳辐射强度迅速下降,从313 W/m2降至273 W/m2,拟浮丝藻密度随之同步迅速上升。可见,水温和光强一旦超过拟浮丝藻生长所需的阈值,环境将会对拟浮丝藻的生长产生负面影响。
氮、磷营养盐是拟浮丝藻生长的必需成分。目前有关拟浮丝藻与营养盐相互关系的研究较为匮乏,关于拟浮丝藻生长的营养盐阈值不同学者有不同的研究结果。Lu等[30]对中国低纬度水库拟浮丝藻的室内培养实验结果显示,拟浮丝藻生长的营养盐阈值中TN为0.8 mg/L且TP为0.01 mg/L。王梦梦[41]对上海市河道水体拟浮丝藻的研究显示,TN和TP浓度分别超过1.5和0.1 mg/L时,拟浮丝藻的生长将不受营养盐限制。本研究发现,高温时段拟浮丝藻的生长与水体NO3--N和DTP浓度有关。NO3--N和DTP是蓝藻可利用的氮、磷形态,高温时段贡湖湾NO3--N和DTP浓度分别为0.078和0.018 mg/L,可能未达到拟浮丝藻生长所需的营养盐阈值[41],因此拟浮丝藻密度随着NO3--N和DTP浓度的上升而增加。
不同于微囊藻等表层生长型蓝藻,拟浮丝藻多分布在水柱亚表层[15]。拟浮丝藻独特的生态位和细胞形态决定其光响应特征,使之与表层微囊藻存在光竞争关系[42]。高温时段,贡湖湾拟浮丝藻密度与微囊藻密度呈负相关,微囊藻密度高值所在区域拟浮丝藻分布的相对较少。研究由此推测,贡湖湾拟浮丝藻与微囊藻的关系与Su等[42]研究结论一致,微囊藻竞争是拟浮丝藻空间分布存在差异的主要原因。此外,高温时段拟浮丝藻的空间分布还与风力有关。调查期间拟浮丝藻主要分布在贡湖湾的东北、东部以及东南沿岸水域,其他水域分布相对较少。贡湖湾平均水深1.82 m[43],水域面积约为164 km2[44],水面开阔,敞水区风浪扰动强度明显大于东部沿岸水域,可能易使拟浮丝藻聚集在贡湖湾东北及东南部沿岸水域。前人研究发现太湖风场影响太湖表层湖流的空间变化[45],导致蓝藻迁移聚集呈差异性空间分布,而高温时段贡湖湾风向多变,对贡湖湾东部沿岸水域拟浮丝藻的空间分布产生一定影响。
4 结论1) 综合显微镜镜检和功能基因检测结果,研究首次识别拟浮丝藻是高温时段贡湖湾2-MIB的主要来源。
2) 贡湖湾2-MIB季节性差异显著,夏季嗅味问题突出。水温、月均太阳辐射、TP和Chl.a是2-MIB季节变化的重要影响因子。
3) 高温时段贡湖湾拟浮丝藻的分布具有时空异质性。拟浮丝藻的时空变化由水温、日均太阳辐射、NO3--N、DTP、风力和微囊藻多个因子共同决定。
| [1] |
Zhang GL, Gu XH, Zhao T et al. Ecological and environmental changes and protection measures of lake in China. Bulletin of Chinese Academy of Sciences, 2023, 38(3): 358-364. [张甘霖, 谷孝鸿, 赵涛等. 中国湖泊生态环境变化与保护对策. 中国科学院院刊, 2023, 38(3): 358-364. DOI:10.16418/j.issn.1000-3045.20230120004] |
| [2] |
Qin BQ, Yang GJ, Ma JR et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China. Chinese Science Bulletin, 2016, 61(7): 759-770. [秦伯强, 杨桂军, 马建荣等. 太湖蓝藻水华"暴发"的动态特征及其机制. 科学通报, 2016, 61(7): 759-770. DOI:10.1360/N972015-00400] |
| [3] |
Watson SB, Ridal J, Boyer GL. Taste and odour and cyanobacterial toxins: Impairment, prediction, and management in the Great Lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2008, 65(8): 1779-1796. DOI:10.1139/f08-084 |
| [4] |
Chiu YT, Yen HK, Lin TF. An alternative method to quantify 2-MIB producing cyanobacteria in drinking water reservoirs: Method development and field applications. Environmental Research, 2016, 151: 618-627. DOI:10.1016/j.envres.2016.08.034 |
| [5] |
Abd El-Hack ME, El-Saadony MT, Elbestawy AR et al. Undesirable odour substances (geosmin and 2-methylisoborneol) in water environment: Sources, impacts and removal strategies. Marine Pollution Bulletin, 2022, 178: 113579. DOI:10.1016/j.marpolbul.2022.113579 |
| [6] |
Mustapha S, Tijani JO, Ndamitso M et al. A critical review on geosmin and 2-methylisoborneol in water: Sources, effects, detection, and removal techniques. Environmental Monitoring and Assessment, 2021, 193(4): 204. DOI:10.1007/s10661-021-08980-9 |
| [7] |
Qiu PF, Chen YX, Li CJ et al. Using molecular detection for the diversity and occurrence of cyanobacteria and 2-methylisoborneol-producing cyanobacteria in an eutrophicated reservoir in northern China. Environmental Pollution, 2021, 288: 117772. DOI:10.1016/j.envpol.2021.117772 |
| [8] |
Shizuka K, Ikenaga M, Murase J et al. Diversity of 2-MIB-Producing cyanobacteria in Lake Ogawara: Microscopic and molecular ecological approaches. Japanese Society for Aquaculture Science, 2020, 68(1): 9-23. DOI:10.11233/aquaculturesci.68.9 |
| [9] |
Izaguirre G, Taylor WD. A Pseudanabaena species from Castaic Lake, California, that produces 2-methylisoborneol. Water Research, 1998, 32(5): 1673-1677. DOI:10.1016/S0043-1354(97)00379-5 |
| [10] |
Su M, Yu JW, Zhang JZ et al. MIB-producing cyanobacteria (Planktothrix sp.) in a drinking water reservoir: Distribution and odor producing potential. Water Research, 2015, 68: 444-453. DOI:10.1016/j.watres.2014.09.038 |
| [11] |
Wu TH, Zhu GW, Wang ZC et al. Seasonal dynamics of odor compounds concentration driven by phytoplankton succession in a subtropical drinking water reservoir, southeast China. Journal of Hazardous Materials, 2022, 425: 128056. DOI:10.1016/j.jhazmat.2021.128056 |
| [12] |
Zhou JW, Zhang LJ, Zhou YK et al. Application of quantitative PCR technology in biomonitoring and assessment of harmful cyanobacteria in Lake Tai. Asian Journal of Ecotoxicology, 2021, 16(6): 13-25. [周君薇, 张丽娟, 周宇昆等. 实时荧光定量PCR技术在太湖蓝藻监测和评估中的应用. 生态毒理学报, 2021, 16(6): 13-25. DOI:10.7524/AJE.1673-5897.20210315002] |
| [13] |
Giglio S, Chou WKW, Ikeda H et al. Biosynthesis of 2-methylisoborneol in cyanobacteria. Environmental Science & Technology, 2011, 45(3): 992-998. DOI:10.1021/es102992p |
| [14] |
Wang ZJ, Song GF, Shao JH et al. Establishment and field applications of real-time PCR methods for the quantification of potential MIB-producing cyanobacteria in aquatic systems. Journal of Applied Phycology, 2016, 28(1): 325-333. DOI:10.1007/s10811-015-0529-1 |
| [15] |
Su M, Suruzzaman MD, Zhu YP et al. Ecological niche and in-situ control of MIB producers in source water. Journal of Environmental Sciences, 2021, 110: 119-128. DOI:10.1016/j.jes.2021.03.026 |
| [16] |
Huang X, Cao PY, Huang ZF et al. Application and research of the detection methods for odorous substance in water reservoirs. Acta Scientiae Circumstantiae, 2019, 39(10): 3503-3507. [黄鑫, 高佩玥, 黄智峰等. 上海水源水库产2-MIB生物总量评估方法与应用. 环境科学学报, 2019, 39(10): 3503-3507. DOI:10.13671/j.hjkxxb.2019.0253] |
| [17] |
Shi PC, Zhu GW, Yang WB et al. Occurrence and influencing factors of odorous compounds in reservoirs used as drinking water resources in Jiangsu Province. Environmental Science, 2019, 40(9): 4000-4008. [史鹏程, 朱广伟, 杨文斌等. 江苏水源地型水库异味物质发生风险及影响因素. 环境科学, 2019, 40(9): 4000-4008. DOI:10.13227/j.hjkx.201812024] |
| [18] |
Lu KY, Chiu YT, Burch M et al. A molecular-based method to estimate the risk associated with cyanotoxins and odor compounds in drinking water sources. Water Research, 2019, 164: 114938. DOI:10.1016/j.watres.2019.114938 |
| [19] |
Olsen BK, Chislock MF, Wilson AE. Eutrophication mediates a common off-flavor compound, 2-methylisoborneol, in a drinking water reservoir. Water Research, 2016, 92: 228-234. DOI:10.1016/j.watres.2016.01.058 |
| [20] |
Cao TX, Fang J, Jia ZY et al. Early warning of MIB episode based on gene abundance and expression in drinking water reservoirs. Water Research, 2023, 231: 119667. DOI:10.1016/j.watres.2023.119667 |
| [21] |
Wu AJ, Wang YD, Friese K et al. Spatial and seasonal distribution of 2-methylisoborneol in a large eutrophic shallow lake, China. Water, Air, & Soil Pollution, 2021, 232(9): 387. DOI:10.1007/s11270-021-05340-8 |
| [22] |
Zhao K, Li ZG, Wei HN et al. The distribution of aquatic vegetation in Gonghu Bay, Lake Taihu, 2012. J Lake Sci, 2015, 27(3): 421-428. [赵凯, 李振国, 魏宏农等. 太湖贡湖湾水生植被分布现状(2012年). 湖泊科学, 2015, 27(3): 421-428. DOI:10.18307/2015.0308] |
| [23] |
Wu DH, Jia GH, Wu HY. Chlorophyll-a concentration variation characteristics of the algae-dominant and macrophyte-dominant areas in Lake Taihu and its driving factors, 2007-2019. J Lake Sci, 2021, 33(5): 1364-1375. [吴东浩, 贾更华, 吴浩云. 2007—2019年太湖藻型和草型湖区叶绿素a变化特征及影响因子. 湖泊科学, 2021, 33(5): 1364-1375. DOI:10.18307/2021.0506] |
| [24] |
Suruzzaman M, Cao TX, Lu JP et al. Evaluation of the MIB-producing potential based on real-time qPCR in drinking water reservoirs. Environmental Research, 2022, 204: 112308. DOI:10.1016/j.envres.2021.112308 |
| [25] |
Zhang Q, Xia YN, Li L et al. Identification and olfactory characteristics of 2-MIB-producing cyanobacteria in Freshwater Algae Culture Collection at the Institute of Hydrobiology (FACHB). Acta Hydrobiologica Sinica, 2023, 47(7): 1115-1128. [张琪, 夏逸若, 李林等. 淡水藻种库(FACHB)库藏产2-MIB蓝藻的鉴定及其产嗅特征研究. 水生生物学报, 2023, 47(7): 1115-1128. DOI:10.7541/2023.2022.0270] |
| [26] |
Deng XW, Qi M, Ren R et al. The relationships between odors and environmental factors at bloom and non-bloom area in Lake Taihu, China. Chemosphere, 2019, 218: 569-576. DOI:10.1016/j.chemosphere.2018.11.121 |
| [27] |
Yang CT, Shen XB, Shi XY et al. Impact of submerged macrophytes on growth and 2-MIB release risk of Pseudanabaena sp.: From field monitoring to cultural experiments. Journal of Hazardous Materials, 2023, 442: 130052. DOI:10.1016/j.jhazmat.2022.130052 |
| [28] |
Su M, Zhu YP, Jia ZY et al. Identification of MIB producers and odor risk assessment using routine data: A case study of an estuary drinking water reservoir. Water Research, 2021, 192: 116848. DOI:10.1016/j.watres.2021.116848 |
| [29] |
Su M, Zhu YP, Andersen T et al. Light-dominated selection shaping filamentous cyanobacterial assemblages drives odor problem in a drinking water reservoir. NPJ Clean Water, 2022, 5(1): 37. DOI:10.1038/s41545-022-00181-2 |
| [30] |
Lu JP, Su M, Su YL et al. Driving forces for the growth of MIB-producing Planktothricoides raciborskii in a low-latitude reservoir. Water Research, 2022, 220: 118670. DOI:10.1016/j.watres.2022.118670 |
| [31] |
Zhang L, Guo GF, Xiong KG et al. Causes of the high temperature process in the Yangtze River Basin in 2022. Progress in Geography, 2023, 42(5): 971-981. [张灵, 郭广芬, 熊开国等. 长江流域2022年夏季高温过程的成因分析. 地理科学进展, 2023, 42(5): 971-981.] |
| [32] |
Su X, Han ZS, Zhang N et al. Seasonal variation rule and source analysis of 2-MIB in a reservoir of Tianjin. China Water & Wastewater, 2020, 36(19): 39-45. [苏晓, 韩正双, 张楠等. 天津某水库2-MIB季节性变化规律及来源分析. 中国给水排水, 2020, 36(19): 39-45. DOI:10.19853/j.zgjsps.1000-4602.2020.19.006] |
| [33] |
Kim S, Hayashi S, Masuki S et al. Effect of rainfall and pH on musty odor produced in the Sanbe Reservoir. Water, 2021, 13(24): 3600. DOI:10.3390/w13243600 |
| [34] |
Rong C, Liu DP, Li Y et al. Source water odor in one reservoir in hot and humid areas of southern China: Occurrence, diagnosis and possible mitigation measures. Environmental Sciences Europe, 2018, 30(1): 45. DOI:10.1186/s12302-018-0175-8 |
| [35] |
Cheng JG, Ma LT, Zhao WY et al. Influence of environmental factors on the growth and odor production of Planktothrix sp. in freshwater. Journal of Hydroecology, 2022, 43(2): 70-76. [成建国, 马力通, 赵文渊等. 环境因素对淡水浮丝藻生长及产生嗅味的影响. 水生态学杂志, 2022, 43(2): 70-76. DOI:10.15928/j.1674-3075.202008180236] |
| [36] |
Perkins RG, Slavin EI, Andrade TMC et al. Managing taste and odour metabolite production in drinking water reservoirs: The importance of ammonium as a key nutrient trigger. Journal of Environmental Management, 2019, 244: 276-284. DOI:10.1016/j.jenvman.2019.04.123 |
| [37] |
Li HM, Gu XH, Chen HH et al. Co-occurrence of multiple cyanotoxins and taste-and-odor compounds in the large eutrophic Lake Taihu, China: Dynamics, driving factors, and challenges for risk assessment. Environmental Pollution, 2022, 294: 118594. DOI:10.1016/j.envpol.2021.118594 |
| [38] |
Wu DH, Chen FF, Hu JX et al. The declining cyanobacterial blooms in Lake Taihu (China) in 2021: The interplay of nutrients and meteorological determinants. Ecological Indicators, 2022, 145: 109590. DOI:10.1016/j.ecolind.2022.109590 |
| [39] |
Wang ZQ, Liu XX, Yao ZH et al. Endogenous release of nitrogen and phosphorus in the Danjiangkou Reservoir. Environmental Science, 2019, 40(11): 4953-4961. [王志齐, 刘新星, 姚志宏等. 丹江口水库氮磷内源释放对比. 环境科学, 2019, 40(11): 4953-4961. DOI:10.13227/j.hjkx.201812206] |
| [40] |
Wu TH, Zhu GW, Zhu MY et al. Effects of algae proliferation and density current on the vertical distribution of odor compounds in drinking water reservoirs in summer. Environmental Pollution, 2021, 288: 117683. DOI:10.1016/j.envpol.2021.117683 |
| [41] |
王梦梦. 上海市河道拉氏拟浮丝藻(Planktonthricoides raciborskii)与环境因子的关系研究[学位论文]. 上海: 上海海洋大学, 2018.
|
| [42] |
Su M, Andersen T, Burch M et al. Succession and interaction of surface and subsurface cyanobacterial blooms in oligotrophic/mesotrophic reservoirs: A case study in Miyun Reservoir. Science of the Total Environment, 2019, 649: 1553-1562. DOI:10.1016/j.scitotenv.2018.08.307 |
| [43] |
Ding JN, Zhang SS, Wu XY et al. Spatial and temporal distribution and health risk assessment of microcystins in water of Gonghu Bay, Taihu Lake. Ecology and Environmental Sciences, 2018, 27(11): 2095-2101. [丁剑楠, 张闪闪, 武旭跃等. 太湖贡湖湾水体中微囊藻毒素的时空分布及健康风险评估. 生态环境学报, 2018, 27(11): 2095-2101.] |
| [44] |
Liu ZJ, Xiao QT, Hu ZH et al. Effects of water diversion from Yangtze River to Lake Taihu on N2O flux in Gonghu Bay, Lake Taihu. China Environmental Science, 2020, 40(12): 5229-5236. [刘臻婧, 肖启涛, 胡正华等. 引江济太对太湖贡湖湾氧化亚氮通量的影响. 中国环境科学, 2020, 40(12): 5229-5236. DOI:10.3969/j.issn.1000-6923.2020.12.015] |
| [45] |
Ding WH, Li Y, Xu SK et al. Characteristics of surface lake current and its effect on cyanobacteria migration in Lake Taihu under changing wind field. Journal of Hohai University: Natural Sciences, 2022, 50(6): 58-65. [丁文浩, 李云, 徐世凯等. 变化风场下太湖表层湖流特征及其对蓝藻迁移的影响. 河海大学学报: 自然科学版, 2022, 50(6): 58-65.] |
 2024, Vol. 36
2024, Vol. 36 

