(2: 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
(3: 浙江大学地球科学学院, 浙江省地学大数据和地球深部资源重点实验室, 杭州 310058)
(4: 南京高科建设发展有限公司, 南京 210038)
(2: State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, P. R. China)
(3: College of Earth Sciences, Zhejiang University, Zhejiang Provincial Key Laboratory of Geoscience Big Data and Deep Earth Resources, Hangzhou 310058, P. R. China)
(4: Nanjing Gaoke Construction Development Co. Ltd, Nanjing 210038, P. R. China)
以羟基自由基(·OH)、单线态氧(1O2)、及超氧阴离子(O 2·-)等为代表的光生活性中间体(photochemically produced reactive intermediates, PPRIs),是一类具有强氧化能力的含氧衍生物或中间代谢产物。PPRIs具有强氧化性,在天然水体中发挥着重要作用:(1)影响有机污染物在水环境中的降解和转化[1];(2)与水中微量元素发生反应,从而影响其化学行为和生物可利用性[2]; (3)改变微生物群落结构和功能[3]。因此,PPRIs在水生生态系统的生物地球化学反应中发挥着重要作用,已成为近年来的研究热点。
天然水体中的可溶性有机质(DOM)在水体中一般会发生两种类型的光化学反应,即直接光反应和间接光反应[4]。直接光反应是DOM分子接受光能后,发生化学反应引起分子架构和组成的直接变化,如使异构化键破裂和光解,并使DOM大分子裂解为小分子[5]。间接光反应是由于DOM中含有苯环、羧基、羟基和羰基等发色团,在光照下会吸收光子,生成激发态的DOM,如单线态的1DOM*和三线态的3DOM*。1DOM*在水体中极不稳定并快速释放电子,进而形成水合电子eaq-,被溶解氧捕获生成O 2·-,O 2·-进一步转化为H2O2,而H2O2是·OH的前驱体,可以生成·OH;3DOM*是DOM产生活性中间体的重要前驱体,在自然水体中主要通过能量传递激发氧分子产生1O2,进而与H2O分子反应生成·OH[6-7]。
环境因子的变化会显著影响水体中PPRIs的光转化动力学和产生途径[8-9]。一方面,有色可溶有机物(CDOM)、硝酸盐和亚硝酸盐等光敏剂对光的吸收是光化学反应的关键影响因素,而环境变化会影响光敏剂的含量;另一方面,环境变化会改变光辐射强度[10]。其中,水深对PPRIs的产生尤其重要,由于深水湖泊底层很难接受到光子能量从而导致PPRIs产生的含量较低,而在浅水和清澈的水体中,光化学反应产生PPRIs的效率较高。不同水环境的光反应性存在显著差异性,同样PPRIs的光化学寿命在不同的水体中也可能有数量级的差异[11]。
鄱阳湖是中国最大的淡水湖,位于长江中下游南岸,年水位变化高达14 m,其中湿地面积超过2500 km2,约占湖泊总面积的78%。鄱阳湖为过水性湖泊,季节变化上呈现“高水是湖,低水似河”的景观特征,独特的“河-湖相”驱动着鄱阳湖湿地生态系统季节变化。在高水位阶段,由于湿地被完全淹没,湿地中初级生产能力较高的生物量的浸提液,如植物残体,为水体输入大量的碳源,从而影响水体的光化学反应,进而影响PPRIs的产生[12]。然而,已有关于鄱阳湖湿地沉积物干湿交替下·OH的产生过程研究[13-14],但对于鄱阳湖这一典型的过水性湖泊水体中PPRIs的季节性变化特征目前鲜有报道,更是缺乏DOM组成的季节性变化对于PPRIs产生影响的研究。
本研究通过对鄱阳湖南矶国家自然保护湿地的水体样本进行了4个季度的光化学分析,比较了3种PPRIs(1O2、·OH及3CDOM*)在不同季节下产生的差异,以期为湿地生态系统修复提供一定的科学依据。
1 材料与方法 1.1 样品采集与处理用5 L采水器分别采集鄱阳湖南矶(图 1)自然保护湿地春季、夏季、秋季和冬季的表层水样,每次采集3~5个重复样品。水样用550℃马弗炉预烧过的GF/F玻璃纤维滤膜进行真空过滤,去除水中的悬浮颗粒物和浮游生物等,-18℃冷冻保存至进一步处理。

|
图 1 鄱阳湖采样点位 Fig.1 Sampling site in Lake Poyang |
由于环境样品中PPRIs浓度较低,因此采样辐照法测定PPRIs的稳态浓度。本研究中辐照法使用的光源为太阳光模拟器(Oriel Sol3A,NewportTM),具体操作如下:首先取过滤后的水样(20 mL)放置于特制的圆柱形石英容器中(直径=4 cm,高度=2.5 cm,厚度=5 mm),随后放于太阳光模拟器下照射,辐射光程为1.6 cm,照射到溶液表面的辐照强度为8 W/m2[12]。在预定的照射时间后,取1 mL的反应溶液后进行PPRIs产生速率分析。实验设置3组平行。
为了测定3CDOM*、1O2和·OH的产生速率,分别采用100 μmol/L 2, 4, 6-三甲苯酚(TMP)、100 μmol/L呋喃甲醇(FFA)和10 mmol/L苯作为3CDOM*、1O2和·OH的捕获剂[15-16]。为探究3种化学探针的直接光降解效率,实验中增加一组对照组,即由锡箔纸包裹石英容器四周,将探针添加到灭菌后的水溶液中,对照组中的水溶液未观察到探针转化,因此这3种化学探针的直接光降解作用可以忽略不计。采用高效液相色谱二极管阵列检测(HPLC-DAD,VWR-Hitachi Elite instrument),配备紫外检测器和反相C18柱(PoPPRIshell 4.6×50 mm,2.7 mm,Agilent)测定捕获剂的变化,进而分析PPRIs含量。HPLC分析参数如下:样品用甲醇和H3PO4水溶液(pH 2.8)的等体积混合物洗脱,流速为1.0 mL/min。TMP、FFA和苯酚的甲醇/水溶液H3PO4分析比例为65 ∶35。保留时间/检测波长分别为3.8 min/220 nm(FFA)、4.2 min/220 nm(苯酚)和11.9 min/220 nm(TMP)。
1.3 PPRIs产生速率计算TMP和FFA在辐照下的时间趋势符合拟一阶动力学[17]。拟合相关时间演化曲线,公式为:
| $ C_t=C_0 \cdot \mathrm{e}^{-k t} $ | (1) |
式中,Ct为辐照t时刻TMP或FFA浓度;C0为初始浓度;k为准一阶降解速率常数。
TMP或FFA初始降解速率计算R:
| $ R=k \cdot C_0 $ | (2) |
式中,C0为TMP或FFA初始浓度。3CDOM*或1O2初始形成速率R为:
| $ R_{{ }^{\mathrm{CDOM}^{*}}} =\left(R_{\mathrm{TMP}}-R_0\right) \cdot\left(\frac{k_{\mathrm{TMP}, { }^3 \mathrm{CDOM}^{*}} [T M P]_0+k^{\prime}}{k_{\mathrm{TMP}, { }^3 \mathrm{CDOM}^{*}} [T M P]_0}\right) $ | (3) |
式中,RTMP为实验测得湖水中TMP转化的初始速率;R0为TMP在空白水中时的速率(挥发和光解);kTMP,3CDOM*为二阶速率常数3×109 L/(mol ·s);k′为其他失活过程准一阶速率常数5×105 s-1;[TMP]0为TMP的初始浓度。
| $R_{^{1}\mathrm{O}_2}=\left(R_{\mathrm{FFA}}-R_0\right) \cdot\left(\frac{k_{\mathrm{FFA}, {^{1}\mathrm{O}_2}}[F F A]_0+k_{^{1}\mathrm{O}_2}}{k_{\mathrm{FFA}, { }^{\prime} {^{1}\mathrm{O}_2}}[F F A]_0}\right) $ | (4) |
式中,RFFA为实验测得湖水中FFA转化的初始速率;R0为FFA在空白水中时的速率(挥发和光解);kFFA,1O2为二阶速率常数1.2×108 M-1 ·s-1;k1O2为其他失活过程准一阶速率常数2.5×105 s-1;[FFA]0为FFA的初始浓度。
3CDOM*的稳态浓度为:
| $ \left[{ }^3 {CDOM}^*\right] \mathrm{ss}=R_{{ }^3 \mathrm{CDOM}^*}\left(k^{\prime}\right)^{-1} $ | (5) |
1O2的稳态浓度为:
| $ \left[{ }^1 O_2\right] \mathrm{ss}=R_{^{1}\mathrm{O}_2}\left(k_{^{1}\mathrm{O}_2}\right)^{-1} $ | (6) |
·OH的测定采用二级速率常数=7.8×109 L/(mol ·s),以95% 的苯转化为苯酚来量化·OH。以10和0.05 mmol/L两种浓度的苯分别测定羟基自由基形成速率(R·OH)和羟基自由基稳态浓度([·OH]ss)。在苯浓度较高(10 mmol/L)的情况下,可以得到·OH的生成速率:
| $ R_{\cdot \text { OH }}=(0.95)^{-1}\left(R_{\text {Phenol }}-R_0\right) \frac{\sum\limits_i k_{\mathrm{Si}}[ { Si }]+k_{\text {Benzene, }\cdot \mathrm{OH}}[ { Benzene }]_0}{k_{\text {Benzene, }\cdot \mathrm{OH}}[ { Benzene }]_0} $ | (7) |
式中,[Benzene]0为苯的初始浓度;RPhenol为实验中测定的苯酚生成速率;R0为苯在空白水中形成苯酚的速率;kBenzene,·OH =7.8×109 L/(mol ·s)为·OH与苯之间的二阶反应速率常数;∑kSi[Si]为一级清除(失活)反应速率常数(低浓度苯=10 μmol/L测定),高浓度苯时此项忽略不计。·OH一级清除(失活)反应速率常数为:
| $ \sum\limits_i k_{\mathrm{Si}}[{Si}]=\frac{0.95 k_B R_{\cdot \text { OH }}[ { Benzene }]}{\frac{\mathrm{d}[ { Phenol }]}{\mathrm{d} t}} $ | (8) |
·OH的稳态浓度为:
| $ [\cdot {OH}] \mathrm{ss}=\frac{R_{\cdot \mathrm{OH}}}{\sum\limits_i k_{\mathrm{Si}}[S i]} $ | (9) |
采用SHIMADZU UV-2550紫外可见分光光度对采集的DOM样本在扫描波长为200~800 nm波段进行全波长扫描,用1 cm石英比色皿,Mili-Q水作空白,按下式对吸收光谱进行校正:
| $ a^{\prime}(\lambda)=2.303 \times O D(\lambda)/r $ | (10) |
| $ a(\lambda)=a^{\prime}(\lambda)-a^{\prime}(700) \cdot \lambda/700 $ | (11) |
式中,a′(λ) 为未经过散射校正的吸收系数,m-1;a(λ) 为经过散射校正后的吸收系数,m-1;r为0.01 m的比色皿光程;OD(λ)为样品原始吸光度。
1.5 三维荧光光谱测定每个DOM样品的激发-发射矩阵(EEM)使用Hitachi F-4600荧光分光光度计检测。在进行荧光光谱分析之前,对基体进行内滤光效应校正,并在350 nm激发波长处用拉曼散射面积进行归一化[18]。这些基质用于确定每个样品的腐殖质指数HIX(在254 nm波长激发光下435~480 nm间荧光峰值除以300~345 nm间荧光峰值与435~480 nm间荧光峰值二者之和)、荧光指数FI(样品在370 nm激发波长下得到的470 nm与520 nm波长处荧光强度的比值)和新鲜度指数β/α(310 nm激发波长下380 nm发射波长处荧光强度与420~435 nm区间最大荧光强度的比值)。
1.6 电喷雾-傅立叶变换-离子回旋共振质谱测定采用电喷雾-傅立叶变换-离子回旋共振质谱ESI-FT-ICR MS(Bruker Daltonics,德国)对提纯后的DOM进行分析。利用5 g Bond Elut PPL固相萃取柱(SPE)(Agilent Technologies)对所有样品进行脱盐和浓缩。然后将所有DOM通过注射泵以120 μL/h的流速引入ESI源。使用Bruker Daltonics数据分析软件进行快速傅里叶变换和幅度计算。所有荷质比m/z范围在150~750 m/z之间,信噪比≥4,并使用所有样品共有的峰的数据列表进行内部校准。
1.7 其他理化指标测定对于0.45 μm滤膜过滤后的湖水样品,用pH计(Sartorius,德国)测定pH值。用总有机碳分析仪(Shimadzu,TOC-L)对样品的溶解有机碳(DOC)浓度进行定量。硝酸根和亚硝酸根阴离子用Thermo Scientific Integrion高压离子色谱仪(HPIC)测定。氨氮浓度采用纳斯勒比色法测定。总氮浓度用碱性过硫酸钾测定。
1.8 数据处理与统计分析采用Origin 9.0(Origin Lab公司)绘制图形,利用SPSS 19.0软件对水质参数进行单因素多重比较分析,采用R语言分析环境因子及DOM组分与PPRIs产生的相关性和差异性,其中P < 0.05为显著水平(*),P < 0.01为极显著水平(**)。
2 结果 2.1 鄱阳湖水体理化性质季节性变化分析鄱阳湖的水质参数呈现出明显的季节性变化特征(表 1)。其中,夏季和秋季pH值较高。相反,NO3-和NO2-浓度在夏季和秋季较低,春季和秋季较高。夏季和秋季的DOC浓度(3.86和3.72 mg/L)显著高于春季和冬季(1.13和3.13 mg/L)(P < 0.01)。
表 1也给出了特定吸收光谱参数SUVA254、E2/E3和光谱斜率SR的季节性变化。夏季和冬季的SUVA254值较高(P < 0.01),分别为13.61和17.88 L/(mg ·m)。而春季和秋季湖泊样品的SUVA254分别为10.64和5.34 L/(mg ·m),明显低于夏季和冬季。另外,秋季湖泊水样中SR和E2/E3值较高,分别为1.08和5.97。
| 表 1 不同季节下鄱阳湖水质参数的比较 Tab. 1 Comparison of water quality parameters in Lake Poyang in different seasons |
荧光指数FI值在夏季和秋季比较低(1.26和1.08),而在春季和冬季比较高(2.26和2.33)。在本研究中,β/α也出现了类似的结果,即与春季和冬季(0.77和0.89)相比,夏季和秋季β/α值较低(0.39和0.28)。与FI值和β/α相反,HIX值在夏季和秋季明显升高,分别为0.78和0.84,春季和冬季分别为0.71和0.72。
2.2 电喷雾-傅立叶变换-离子回旋共振质谱测定结果分析根据上述分析结果,将夏、秋季样品和冬、春季样品分别合并,测定不同时期的有机质组成。结果表明,不同季节水样中含有丰富的脂类(lipid)、蛋白类(protein)、多糖类(carbohydrate)、木质素类(ligin)、不饱和烃类(UH)组分。夏、秋季样品中的脂类、蛋白质、木质素、不饱和烃类组分均高于冬、春季样品,尤其是夏、秋季木质素(24.19%)丰度明显高于冬、春季(17.45%)(图 2)。
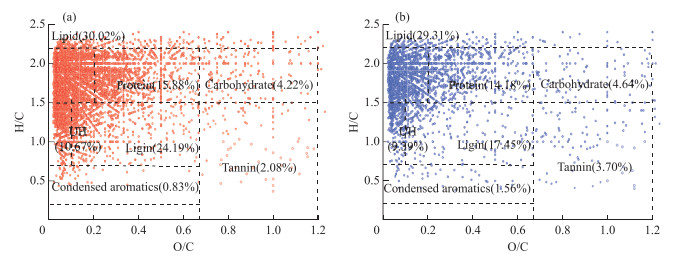
|
图 2 夏、秋季(a)和冬、春季(b)水样ESI FT-ICR MS谱峰的分子公式Van Krevelen图 Fig.2 Van Krevelen plots for molecular formulae specific to ESI FT-ICR MS spectral peaks during summer and autumn (a), winter and spring (b) |
图 3显示了3CDOM*与辐照时间的关系,斜率的大小反映了水体中3CDOM*产生活性。结果表明,不同季节鄱阳湖水体3CDOM*产生能力由大到小依次为秋季>夏季>春季>冬季。进一步分析发现,3CDOM*在夏季和秋季的产生速率和稳态浓度显著高于冬季和春季,尤其是在秋季,产生速率和稳态浓度分别达到了4.48×10-9 mol/(L ·s)和0.90×10-15 mol/L(表 2)。
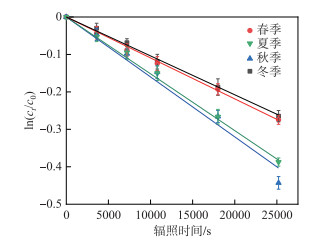
|
图 3 TMP在模拟日照条件下随时间的演化 Fig.3 Evolution of TMP over time under simulated sunshine conditions |
| 表 2 TMP随时间演化的相关参数比较 Tab. 2 Comparison of relevant parameters of TMP evolution over time |
使用FFA作为选择性探针,对辐照后的湿地样本产生的1O2进行量化分析(图 4)。结果表明,夏季和秋季水体中1O2产生速率分别为4.20×10-9和3.90×10-9 mol/(L ·s),高于春季和冬季水体中1O2产生速率(2.78×10-9和2.62×10-9 mol/(L ·s)),夏季和秋季水体中1O2的稳态浓度分别达到了0.17×10-15和0.16×10-15 mol/L(表 3)。
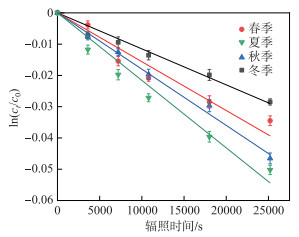
|
图 4 FFA在模拟日照条件下随时间的演化 Fig.4 Evolution of FFA over time under simulated sunshine conditions |
| 表 3 FFA随时间演化的相关参数比较 Tab. 3 Comparison of relevant parameters of FFA evolution over time |
已有研究发现,地表水的·OH产生速率通常在10-12~10-9 s-1之间[19],本研究也发现了类似的量级(10-10~10-9 s-1)(图 5,表 4)。南矶湿地夏、秋季水体中的·OH产生速率(13.06×10-10和13.70×10-10 s-1)明显高与冬、春季(11.12×10-10和12.06×10-10 s-1)。

|
图 5 在初始浓度为10 mmol/L的苯生成苯酚的演化 Fig.5 Evolution of phenol from benzene at initial concentrations of 10 mmol/L |
| 表 4 苯酚随时间演化的相关参数比较 Tab. 4 Comparison of relevant parameters of phenol evolution over time |
进一步通过Spearman秩相关分析热图分析环境因子及DOM组分与PPRIs产生的相关性(图 6)。结果表明,pH、DOC、E2/E3、脂类、蛋白类及木质素类与PPRIs产生速率展现出了良好的正相关关系,尤其是其中的DOC与木质素类组分,证明PPRIs的光化学产生可能与植物源DOM密切相关。另外在三维荧光指标结果中,荧光指数(FI)和新鲜度指数(β/α)与PPRIs呈现了负相关关系,证明FI值越低即DOM陆源性越高、非新生DOM比例越多,则PPRIs产生速率越高。

|
图 6 环境因子及DOM组分与PPRIs产生特征的Spearman秩相关分析热图 Fig.6 Heat map of Spearman's rank correlation analysis of DOM compositions and environmental factors with PPRIs production characteristics |
本研究发现,鄱阳湖水体的理化性质呈现明显的季节性差异,其中夏、秋季水体的pH和DOC浓度较高,而冬、春季NO3-和NO2-浓度较高。通过紫外吸收光谱和三维荧光光谱进一步发现,夏、秋季水体的E2/E3和HIX水平较高,而冬、春季水体的FI和β/α含量较高,夏、冬季的SUVA254值较高。E2/E3(吸收系数比)是波长在250和365 nm处吸收系数的比值,指示吸光分子通过电荷转移发生光化学反应的情况,也是DOM分子大小的反向指标,E2/E3值越大,DOM分子量越小[17]。E2/E3也被报道为1O2和3CDOM*产生的预测因子,一般来说,较高的E2/E3比率导致较高的1O2和3CDOM*产率[20-21]。SUVA254是254 nm处的特定紫外线吸收率,表征了DOM芳烃度,通常SUVA254越高,芳烃含量越高[17]。FI是样品在370 nm激发波长下得到的470与520 nm波长处荧光强度的比值。FI值小于1.3时属于陆源输入,夏、秋季的有机质主要来自陆生植物和土壤有机质[22-23]。而在春季和冬季高于1.9,代表细菌和藻类的胞外释放和渗出,即主要来自湖泊本身和微生物产生的有机质,属于内源[24]。以往的研究表明,随着水体中DOM降解的增强和内源性碳产物的产生,FI和β/α均增加,表明这两个指标是内在关联的[25]。本研究结果发现,夏、秋季DOM中芳香族化合物丰度较高,并且腐殖化程度增加。
进一步通过室内实验发现,鄱阳湖湿地水样通过辐照产生了3CDOM*、1O2和·OH活性物种,同样呈现明显的季节性差异,总体来说,夏、秋季水体中PPRIs的产生速率和含量均高于秋、冬季。根据鄱阳湖年水量变化的实际情况,7—10月为丰水期,水位处于起落初期,最高水位达到20.74 m,湖泊近岸和湿地被淹没。相反,在春季和冬季,水位下降至4~10 m,低于陆地植物线,为枯水期。鄱阳湖水体在丰水期相较于枯水季有更显著的光活性,从而产生更多的PPRIs。结合CDOM/DOM的紫外吸收、荧光特征及质谱分析结果发现,鄱阳湖水体中PPRIs的产生差异性与水体中DOM的组分密切相关[26]。丰水季的湿地源有机质表现出强烈的陆源输入,包括土地淋洗、降水和大型植物残体分解释放。ESI-FT-ICR MS结果证实,夏、秋季水体中含有丰富的木质素组分,而木质素具有较高的光化学活性[27],因此可以推断,淹水植物残体降解过程释放的有机组分,对夏、秋季DOM的来源和组成有着极易被忽视的影响和作用,而其中光化学活性较强的有机组分如木质素是造成PPRIs产率更高的主要原因[28]。据报道,溶解有机质中的低分子量(LMW)组分相比高分子量(HMW)组分会产生更高的PPRIs[29-30],Tai等通过对废水处理过程中DOM的光降解实验发现,HMW组分降解为LMW组分过程可以有效促进1O2的形成[31],这与本研究中E2/E3和1O2的关系类似。这一发现很有意义,因为南矶是一个受保护的大型湿地,也是有机质来源最丰富的湿地之一,这与夏、秋季的丰水期DOC含量较高相符合,推测是由于在水位高的时候,大量陆地生物被淹没,导致植物残体和肥沃的土壤有机质释放到湖中产生。HIX、β/α作为表征DOM的腐殖化程度或新鲜度指数的参数,显示了与3种PPRIs的产生速率相同的变化规律。
与3CDOM*和1O2不同的是,DOM既是·OH产生的来源,又是天然水中·OH的主要清除剂,同时还存在碳酸氢盐、碳酸氢盐和氯化物对·OH清除的影响。此前有报道[11],在天然湖泊样品中,DOM能够占·OH清除量的80%。DOM引起的光衰减和猝灭作用共同抑制羟自由基稳态浓度增长,·OH的形成和清除作用共同决定了·OH的稳态浓度。因此可以看到春季有着最低的·OH产生速率,因为淬灭速率较低的情况下,却有着较高的稳态浓度(7.83×10-16 mol/L)。
对于鄱阳湖这一典型的干湿交替的湿地型湖泊来说,丰水期和枯水期的PPRIs的产生速率和产生量均不同,而PPRIs具有强氧化性,对有机污染物及难降解有机物具有较高的去除能力,已有研究发现,PPRIs诱导的有机微污染物光降解反应与光反应体系中的稳态浓度以及有机污染物与PPRIs的二次反应速率常数有关[32],因此推测对于不同时期水体中的污染物的降解势必存在不同的影响。在丰水期间,水体污染物主要来自集水区域,如农业土壤和池塘、城市地区、湿地的外源输入。本研究发现,湿地源表层湖泊水体中有(C)DOM具有较高的3CDOM*、1O2和·OH的产生能力,这对有机污染物的去除具有积极的影响。而在枯水期间,由于水位降低水量减少,水体中污染物浓度增加,但增加的污染物浓度可以由水体中加强的光化学过程得到部分补偿,因此,尽管枯水期PPRIs产生含量较低,但是如果光强增强,同样对有机污染物的去除具有积极作用,另外,鄱阳湖在枯水期间,急剧减少的面积倾向于形成一个碟形湖,这个过程减慢了水流,从而可能有足够的时间来确保污染物的光降解[33]。以往研究发现,在长期干旱期间河流造成的极低流量条件下,光降解难降解化合物将变得非常重要[16]。因此,当丰水期和枯水季交替成为湿地流域的常态时,即使光化学活性不如丰水期那么高,湿地光化学在枯水季节也更有可能消除污染物。需要进一步研究确定有机化合物对不同时期和不同来源的污染物的响应能力的差异,本研究对了解阶段性污染防治具有重要意义。
4 结论1) 鄱阳湖水质指标呈现显著的季节差异性,其中春、冬季水体中含有较高水平的NO3-和NO2-浓度以及FI和β/α,夏、秋季水体呈现出较高的DOC、E2/E3和HIX水平。
2) 鄱阳湖水体中PPRIs的产生同样呈现显著的季节性差异,总体表现为夏、秋季高于冬、春季,即丰水期高于枯水期的变化趋势。
3) 丰水期PPRIs具有较高的PPRIs产生速率,与这一时期的DOM组分密切相关,丰水期较高的水体DOM主要来自陆生植物和土壤有机质,并含有更高的芳香性及腐殖化水平,尤其其中的光敏性物质-木质素显著增加,促使这一时期的水体具有更高的光催化活性。而在春、冬季,偏低的水体有机质主要来自湖泊本身和微生物产生的有机质,属于内源。
| [1] |
Cristale J, Dantas RF, Luca AD et al. Role of oxygen and DOM in sunlight induced photodegradation of organophosphorous flame retardants in river water. Journal of Hazardous Materials, 2017, 323(SI): 242-249. DOI:10.1016/j.jhazmat.2016.05.019 |
| [2] |
Hansel CM, Zeiner CA, Santelli CM et al. Mn(Ⅱ) oxidation by an ascomycete fungus is linked to superoxide production during asexual reproduction. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(31): 12621-12625. DOI:10.1073/pnas.1203885109 |
| [3] |
Pancotto VA, Sala OE, Cabello M et al. Solar UV-B decreases decomposition in herbaceous plant litter in Tierra del Fuego, Argentina: Potential role of an altered decomposer community. Global Change Biology, 2003, 9(10): 1465-1474. DOI:10.1046/j.1365-2486.2003.00667.x |
| [4] |
Gligorovski S, Strekowski R, Barbati S et al. Environmental implications of hydroxyl radicals (·OH). Chemical Reviews, 2015, 115(24): 13051-13092. DOI:10.1021/cr500310b |
| [5] |
Landry C, Tremblay L. Compositional differences between size classes of dissolved organic matter from freshwater and seawater revealed by an HPLC-FTIR system. Environmental Science & Technology, 2012, 46(3): 1700-1707. DOI:10.1021/es203711v |
| [6] |
Parker KM, Pignatello JJ, Mitch WA. Influence of ionic strength on triplet-state natural organic matter loss by energy transfer and electron transfer pathways. Environmental Science & Technology, 2013, 47(19): 10987-10994. DOI:10.1021/es401900j |
| [7] |
Xu HC, Guo LD. Molecular size-dependent abundance and composition of dissolved organic matter in river, lake and sea waters. Water Research, 2017, 117: 115-126. DOI:10.1016/j.watres.2017.04.006 |
| [8] |
Zhang YL, Qin BQ, Ma RH et al. Absorption and fluorescence characteristics of colored soluble organic matter in typical grass and algae-type lakes of Taihu Lake. Environmental Science, 2005, 26(2): 142-147. [张运林, 秦伯强, 马荣华等. 太湖典型草、藻型湖区有色可溶性有机物的吸收及荧光特性. 环境科学, 2005, 26(2): 142-147. DOI:10.13227/j.hjkx.2005.02.029] |
| [9] |
Qin BQ, Wu QN, Gao JF et al. Water environmental issues in Taihu Lake of China: Problems, causes and management. Journal of Natural Resources, 2002, 17(2): 221-228. [秦伯强, 吴庆农, 高俊峰等. 太湖地区的水资源与水环境——问题、原因与管理. 自然资源学报, 2002, 17(2): 221-228. DOI:10.1007/BF02943285] |
| [10] |
Zhang T, Hansel CM, Voelker BM et al. Extensive dark biological production of reactive oxygen species in brackish and freshwater ponds. Environmental Science & Technology, 2016, 50(6): 2983-2993. DOI:10.1021/acs.est.5b03906 |
| [11] |
Scheffer M, van Nes EH. Shallowlakes theory revisited: Various alternative regimes driven by climate, nutrients, depth and lake size. Hydrobiologia, 2007, 584(1): 455-466. DOI:10.1007/s10750-007-0616-7 |
| [12] |
Xu F, Yang ZF, Chen B et al. Impact of submerged plants on ecosystem health of the plant-dominated Baiyangdian Lake, China. Ecological Modelling, 2013, 252(SI): 167-175. DOI:10.1016/j.ecolmodel.2012.07.013 |
| [13] |
Du HY, Cao YX, Li Z et al. Formation and mechanisms of hydroxyl radicals during the oxygenation of sediments in Lake Poyang, China. Water Research, 2021, 202: 117442. DOI:10.1016/j.watres.2021.117442 |
| [14] |
姚志东. 鄱阳湖变化水文条件下光照对苦草生长的影响[学位论文]. 南昌: 南昌工程学院, 2018.
|
| [15] |
Vione D, Falletti G, Maurino V et al. Sources and sinks of hydroxyl radicals upon irradiation of natural water samples. Environmental Science & Technology, 2006, 40(12): 3775-3781. DOI:10.1021/es052206b |
| [16] |
Boreen AL, Edhlund BL, Cotner JB et al. Indirect photodegradation of dissolved free amino acids: The contribution of singlet oxygen and the differential reactivity of DOM from various sources. Environmental Science & Technology, 2008, 42(15): 5492-5498. DOI:10.1021/es800185d |
| [17] |
alHousari F, Vione D, Chiron S et al. Reactive photoinduced species in estuarine waters. Characterization of hydroxyl radical, singlet oxygen and dissolved organic matter triplet state in natural oxidation processes. Photochemical & Photobiological Sciences: Official Journal of the European Photochemistry Association and the European Society for Photobiology, 2010, 9(1): 78-86. DOI:10.1039/b9pp00030e |
| [18] |
Rochelle-Newall EJ, Fisher TR. Chromophoric dissolved organic matter and dissolved organic carbon in Chesapeake Bay. Marine Chemistry, 2002, 77(1): 23-41. DOI:10.1016/S0304-4203(01)00073-1 |
| [19] |
Sun LN, Qian JG, Blough NV et al. Insights into the photoproduction sites of hydroxyl radicals by dissolved organic matter in natural waters. Environmental Science & Technology Letters, 2015, 2(12): 352-356. DOI:10.1021/acs.estlett.5b00294 |
| [20] |
Minella M, De Laurentiis E, Buhvestova O et al. Modelling lake-water photochemistry: Three-decade assessment of the steady-state concentration of photoreactive transients (·OH, CO3-· and 3CDOM*) in the surface water of polymictic Lake Peipsi (Estonia/Russia). Chemosphere, 2013, 90(10): 2589-2596. DOI:10.1016/j.chemosphere.2012.10.103 |
| [21] |
Chien SH, Cheng MF, Lau KC et al. Theoretical study of the Diels—Alder reactions between singlet (1Δg) oxygen and acenes. The Journal of Physical Chemistry A, 2005, 109(33): 7509-7518. DOI:10.1021/jp0503009 |
| [22] |
Liu X, Wu DG, Jiang HL et al. The production process of reactive oxygen radicals in the degradation process of grass-source dissolved organic matter. J Lake Sci, 2020, 32(2): 440-449. [刘新, 吴定桂, 江和龙等. 草源型可溶性有机物降解过程中活性氧物种产生过程. 湖泊科学, 2020, 32(2): 440-449. DOI:10.18307/2020.0213] |
| [23] |
Hansen AM, Kraus TEC, Pellerin BA et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation. Limnology and Oceanography, 2016, 61(3): 1015-1032. DOI:10.1002/lno.10270 |
| [24] |
Minero C, Chiron S, Falletti G et al. Photochemincal processes involving nitrite in surface water samples. Aquatic Sciences, 2007, 69(1): 71-85. DOI:10.1007/s00027-007-0881-6 |
| [25] |
Vione D, Lauri V, Minero C et al. Photostability and photolability of dissolved organic matter upon irradiation of natural water samples under simulated sunlight. Aquatic Sciences, 2009, 71(1): 34-45. DOI:10.1007/s00027-008-8084-3 |
| [26] |
Marchisio A, Minella M, Maurino V et al. Photogeneration of reactive transient species upon irradiation of natural water samples: Formation quantum yields in different spectral intervals, and implications for the photochemistry of surface waters. Water Research, 2015, 73: 145-156. DOI:10.1016/j.watres.2015.01.016 |
| [27] |
Kuehn KA, Ohsowski BM, Francoeur SN et al. Contributions of fungi to carbon flow and nutrient cycling from standing dead Typha angustifolia leaf litter in a temperate freshwater marsh. Limnology and Oceanography, 2011, 56(2): 529-539. DOI:10.4319/lo.2011.56.2.0529 |
| [28] |
Berg B, McClaugherty C. Plant litter: Decomposition, humus formation, carbon sequestration. Berlin: Springer Berlin Heidelberg, 2014. DOI: 10.1007/978-3-642-38821-7.
|
| [29] |
Dalrymple RM, Carfagno AK, Sharpless CM. Correlations between dissolved organic matter optical properties and quantum yields of singlet oxygen and hydrogen peroxide. Environmental Science & Technology, 2010, 44(15): 5824-5829. DOI:10.1021/es101005u |
| [30] |
Grandbois M, Latch DE, McNeill K. Microheterogeneous concentrations of singlet oxygen in natural organic matter isolate solutions. Environmental Science & Technology, 2008, 42(24): 9184-9190. DOI:10.1021/es8017094 |
| [31] |
Tai C, Zhang SD, Wang J et al. Solar-induced generation of singlet oxygen and hydroxyl radical in sewage wastewaters. Environmental Chemistry Letters, 2017, 15(3): 515-523. DOI:10.1007/s10311-017-0625-3 |
| [32] |
Li YJ, Chen JW, Qiao XL et al. Insights into photolytic mechanism of sulfapyridine induced by triplet-excited dissolved organic matter. Chemosphere, 2016, 147: 305-310. DOI:10.1016/j.chemosphere.2015.12.115 |
| [33] |
Xu YY, Li J, Wang JD et al. Assessing water storage changes of Lake Poyang from multi-mission satellite data and hydrological models. Journal of Hydrology, 2020, 590: 125229. DOI:10.1016/j.jhydrol.2020.125229 |
 2024, Vol. 36
2024, Vol. 36 

