(2: 水利部水工程生态效应与生态修复重点实验室, 武汉 430079)
(3: 湖北省水生态保护与修复工程技术研究中心, 武汉 430079)
(4: 江西省水文监测中心, 南昌 330002)
(5: 鄱阳湖水文生态监测研究重点实验室, 南昌 330002)
(6: 生态环境部长江流域生态环境监督管理局生态环境监测与科学研究中心, 武汉 430011)
(7: 生态环境部海河流域北海海域生态环境监督管理局生态环境监测与研究中心, 天津 300061)
(2: Key Laboratory of Ecological Impacts of Hydraulic-projects and Restoration of Aquatic Ecosystem, Wuhan 430079, P. R. China)
(3: Hubei Engineering Research Center of Hydroecology Protection and Restoration, Wuhan 430079, P. R. China)
(4: Jiangxi Hydrological Monitoring Center, Nanchang 330002, P. R. China)
(5: Poyang Lake Key Laboratory of Hydroecological Monitoring, Nanchang 330002, P. R. China)
(6: Ecological Environment Monitoring and Scientific Research Center of Yangtze River Basin, Ecological Environment Supervision and Administration Bureau of the Ministry of Ecology and Environment, Wuhan 430011, P. R. China)
(7: Ecological Environment Monitoring and Scientific Research Center of Haihe River Basin and Beihai Sea Area, Ecological Environment Supervision and Administration Bureau of the Ministry of Ecology and Environment, Tianjin 300061, P. R. China)
江西省(24°29′~30°04′N,113°34′~118°28′E)位于长江中下游南岸,总面积约为16.69万km2[1]。该地区拥有众多湖泊,尤其是以鄱阳湖为中心的周边湖泊分布密集。作为江西省最大的湖泊,鄱阳湖具有独特的地理位置和水文特征,形成了独特的水生态系统[2],因具有极其丰富的生物多样性而备受关注,针对鄱阳湖的水生态调查成果较多[3-7]。大型底栖无脊椎动物作为水生态系统中重要的组成部分,被广泛应用于水环境监测和生态系统健康评估。据文献调研资料显示,针对江西大型底栖无脊椎动物的调查研究主要集中在鄱阳湖水域及其五大入湖支流水系[2, 6-11],而对鄱阳湖周边的中小型湖泊关注较少[12-13]。目前,针对大尺度湖群的大型底栖无脊椎动物生态学研究主要集中在长江中下游的浅水湖泊。例如,蔡永久等对长江中下游地区4种不同类型(草型、天然养殖、施肥养殖和城市湖泊)10个湖泊的大型底栖无脊椎动物群落结构和多样性进行了研究,并分析了与水体营养状况之间的关系[14];此外,还对洞庭湖群、江汉湖群、鄱阳湖群、华阳湖群和太湖湖群5个湖群的69个湖泊进行了大型底栖无脊椎动物和水化学调查,并分析了区域过程和局部环境条件在决定底栖群落结构中的相对重要性[15]。尽管已经有一些研究案例涉及江西的一些湖泊,但覆盖的湖泊数量有限,且多局限于鄱阳湖周边的少数几个湖泊,未完全覆盖江西省境内的主要湖泊。此外,江西省的湖泊多环绕鄱阳湖水系和修水水系分布,集聚于鄱阳湖平原区,大多属于调蓄性湖泊[16],各湖泊因水动力条件差异较大而各具特色。
人类的过度开发活动在时间和空间尺度上极大地改变了湖泊的生态系统,产生了许多不良后果,如水质恶化、水生动物可栖息面积的减少以及淡水生物群落的退化,最终导致生态系统功能的失调和营养动态的变化[17]。目前,我国东部湖泊退化现象严重,大部分湖泊水生态系统面临较为严重的生态问题(如湖泊富营养化、生物多样性降低)[18]。大型底栖无脊椎动物是水生态系统整体生物多样性的主要组成部分,它们可以有效处理沉积物,加速营养循环,并通过食物网传递能量,促进生态系统的正常运转[17, 19]。研究结果表明,江西鄱阳湖湖区大型底栖无脊椎动物多样性呈现下降趋势,物种组成上呈现部分耐污种逐渐占优势地位的格局,且与相近地理区域富营养化湖泊(巢湖、太湖)的群落结构愈发趋同[6]。近年来的普查工作表明,江西浅水湖泊管理和保护中存在着湖泊数量减少、面积萎缩、水体污染、水体环境变差、生态系统退化等诸多问题。大型底栖无脊椎动物作为水体底部的哨兵,其群落结构和多样性的现状和变化趋势可以有效反映湖泊水生态系统的现状以及相关部门湖泊管理和保护工作的成效[20-21]。自2018年以来,江西省水文局牵头对江西省76个面积在1 km2以上的湖泊进行了每年两次的水生态监测。本研究基于2019年度的调查成果,对江西省76个湖泊大型底栖无脊椎动物的群落结构和多样性进行了分析,并结合环境理化因子,探讨了大型底栖无脊椎动物群落结构以及多样性与环境因子之间的关系。研究旨在全面了解江西浅水湖泊大型底栖无脊椎动物现状的基础上,找出影响大型底栖无脊椎动物多样性的重要环境因子,为江西省浅水湖泊的精准化管理提供科学依据和技术支持。
1 材料与方法 1.1 研究地点选取江西省水域面积在1 km2以上的76个浅水湖泊进行水生态调查。这些湖泊涵盖鄱阳湖及其周边的中小湖泊,水域面积在1.08~2978 km2之间变动。青山湖、泊头湖、珠湖、南北港和新妙湖设置2个采样点位,陈家湖、康山湖、白水湖和赤湖设置3个点位,赛湖设置4个点位,军山湖设置5个点位,瑶湖和八里湖设置8个点位,鄱阳湖由于水域面积较大,设置13个采样点位,其余湖泊设置1个点位(图 1,附表Ⅰ)。

|
图 1 江西省浅水湖泊分布 Fig.1 Distribution of shallow lakes in Jiangxi Province involved in this study |
采样时间为2019年春季(4月)和秋季(10月)。使用GPS对采样站点进行精确定位。到达预先设置的采样点位后,使用彼得逊采泥器(面积1/16 m2)进行定量采样。每个采样站点采集2~4个重复样品,合并成一个样品。采集的泥样经过孔径为0.25 mm的绢布在水中进行清洗,然后将粗样装入封口袋中,带回实验室进一步处理。在实验室中,对采集的样本进行分拣,再用10% 的福尔马林溶液固定保存。标本鉴定时参照大型底栖无脊椎动物专业分类文献将标本鉴定至尽可能低的分类单元[22-24],同时使用精度为万分之一的电子天平对湿重进行称量计数。采集大型底栖无脊椎动物的同时,使用多参数水质分析仪测定各个采样点的水温(WT)、溶解氧(DO)和pH值,透明度(SD)则使用塞氏盘测量。同步采集水样送回实验室测定总氮(TN)、总磷(TP)、氨氮(AN)、硝态氮(NO3--N)、叶绿素a(Chl.a)和高锰酸盐指数(CODMn)[25]。浮游植物丰度(PhA)、硅藻丰度(BaA)、蓝藻丰度(CyA)和绿藻丰度(ChA)数据来自水生态调查同步获取的浮游植物数据。
1.3 数据分析在本研究中,使用了多种分析手段来探索大型底栖无脊椎动物群落和多样性之和环境因子间的关系。(1)使用Mann-Whitney检验来比较不同季节的环境因子之间是否存在显著差异;(2)采用Mcnaughton优势度指数(Y)来确定大型底栖无脊椎动物的优势种。当Y值大于0.02时,将该物种视为优势种[26];(3)采用多响应置换过程(multi-response permutation procedures,MRPP)检验来评估不同群组之间的差异显著程度;(4)采用百分比相似性分析(similarity percentage,SIMPER)找出造成群组差异的主要分类单元;(5)采用聚类分析将湖泊按照大型底栖无脊椎动物类群组成和摄食功能群组成进行分组,并采用主成分分析(principal component analysis, PCA)展示不同群组间的关系,帮助我们理解不同湖泊之间的相似性和差异性;(6)采用指示种分析(indicator of species analysis,ISA)找出不同群组的指示分类单元,进一步揭示不同湖泊群组的特征;(7)采用偏最小二乘法回归模型(partial least squares regression,PLSR)分析寻找影响大型底栖无脊椎动物多样性的重要环境因子,在PLSR回归模型中,VIP(variable importance in projection)是一种用于评估变量(环境因子)对模型的重要性的指标,VIP>0.8被认为是具有显著影响的阈值。(8)采用基于偏最小二乘法的结构方程模型(PLS-SEM)探讨水体理化特征、藻类种群动态、大型底栖无脊椎动物多样性三者之间的关系。使用PC-ORD V7.0软件进行MRPP、PCA、聚类分析和ISA分析[27]。使用PAST v3.0软件进行SIMPER分析[28]。使用GraphPad Prism v8.0软件绘图。采用OriginPro 2018软件进行PLSR分析。采用SmartPLS v4.0软件进行PLS-SEM分析。
在本研究中,我们采用了3个常用的大型底栖无脊椎动物多样性测度指标,包括Fisher指数、Shannon-Wiener指数和Pielou均匀度指数。Fisher指数是一种基于统计学的多样性指标,适用于对数级数分布,能够较好地反映群落中的有效物种数。Fisher指数的计算公式为:S=a×ln(1+n/a),其中S为物种数,n为物种个数,a为Fisher指数。Shannon-Wiener指数是基于信息学的测度指标,用于评估群落中物种的多样性。Pielou均匀度指数也是一种基于信息学的指标,用于评估群落中物种的均匀度[29-30]。这些指标均使用PAST v3.0软件进行计算[28]。大型底栖无脊椎动物摄食功能群参考Cummins等大型底栖无脊椎动物功能摄食类群的分类方法[31-33],将江西浅水湖泊大型底栖无脊椎动物划分为5类,分别为刮食者、撕食者、收集者、滤食者和捕食者。
2 结果与分析 2.1 环境因子经Mann-Whitney检验,春季浮游植物丰度、蓝藻丰度、水温和透明度显著低于秋季(P < 0.01)。春季溶解氧显著高于秋季(P < 0.01)。尽管总氮、硝态氮和叶绿素a的均值在春季高于秋季,而硅藻丰度、绿藻丰度、总磷、氨氮、pH和高锰酸盐指数的均值在春季低于秋季,但在统计上差异不具有显著性(P>0.05)。从表 1可以看出,江西省各湖泊在水环境参数上存在较大的差异。
| 表 1 江西浅水湖泊春秋季水环境参数 Tab. 1 Environmental parameters of shallow lakes of Jiangxi Province in Spring and Autumn |
两次调查共检出140个分类单元,分属于4门8纲17目51科(附表Ⅱ)。其中多毛类1种,寡毛类18种,甲壳动物9种,软体动物32种,水生昆虫69种,其中摇蚊类37种,占到了水生昆虫物种数的53.62%。春季检出104个分类单元,其中水生昆虫占比49.71%,寡毛类占比28.65%,软体动物占比20.28%;秋季检出97个分类单元,其中水生昆虫占比80.95%,软体动物占比6.56%,寡毛类占比9.71%,甲壳动物占比2.09%。春季优势分类单元为摇蚊属一种Chironomus sp.、长足摇蚊属一种Tanypus sp.和霍甫水丝蚓Limnodrilus hoffmeisteri,秋季优势分类单元为长足摇蚊属一种和摇蚊属一种Chironomus sp.。经过MRPP检验,春季和秋季大型底栖无脊椎动物群落结构的差异显著(T=-10.13, A=0.016, P < 0.0001)。SIMPER分析结果表明,长足摇蚊属一种、摇蚊属一种、石田螺属一种(环棱螺属一种)、霍甫水丝蚓和苏氏尾鳃蚓是造成季节差异的主要分类单元,这些分类单元的组间差异累计贡献率达到了31.63%。
综合两次调查的结果,发现不同大型底栖无脊椎动物类群在湖泊水体中的出现频次和分布范围存在差异。水生昆虫是出现频次最高的类群,占96.05%,其中摇蚊类也占96.05%;其次是寡毛类,占85.53%;软体动物占71.05%;甲壳动物占30.26%;多毛类占3.95%;其他类群占28.95%。根据分布范围来看,水生昆虫分布于73个湖泊,其中摇蚊类也分布于73个湖泊,寡毛类分布于65个湖泊,软体动物分布于54个湖泊,甲壳动物在23个湖泊中均有出现,而多毛类分布范围有限,只出现在3个湖泊。
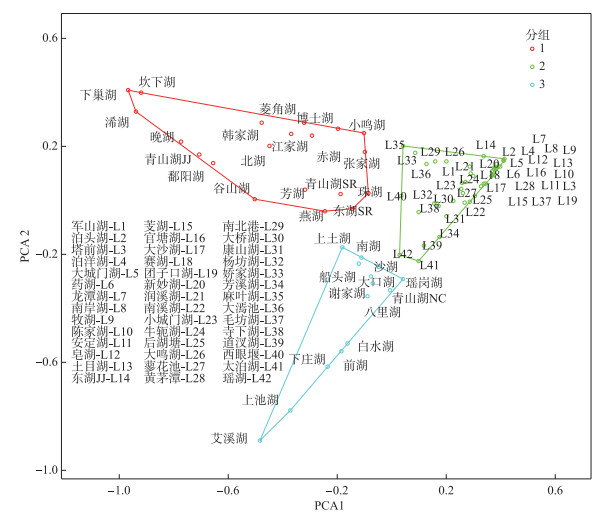
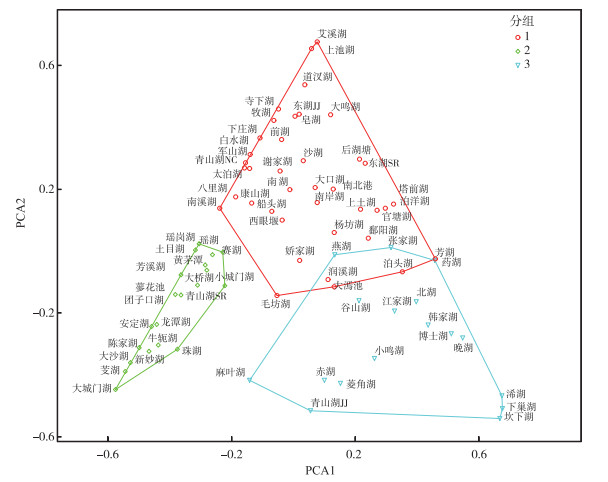
根据大型底栖无脊椎动物的类群组成进行聚类分析,可以将76个湖泊分为3组。组1的指示类群为软体动物,组2的指示类群为水生昆虫,组3的指示类群为寡毛类(图 2)。就摄食功能群密度占比来看,捕食者和收集者的密度占比较高,分别为40.58% 和36.23%。刮食者占比为11.27%,撕食者占比为9.66%,而滤食者的占比最低,只有2%。根据大型底栖无脊椎动物的功能群组成情况进行聚类分析,可以将76个湖泊分为3组。组1的指示功能群为收集者,组2的指示功能群为捕食者,组3的指示功能群为刮食者(图 3)。
|
图 2 基于PCA分析的大型底栖无脊椎动物类群双序图(分组基于聚类分析结果) Fig.2 The biplot of macroinvertebrate broad taxonomic groups based on PCA analysis result(the different groups are from the cluster analysis result) |
|
图 3 基于PCA分析的大型底栖无脊椎动物摄食功能群双序图(分组是基于聚类分析结果) Fig.3 The biplot of feeding functional groups of macroinvertebrates based on PCA analysis result(the different groups are from the cluster analysis result) |
Fisher指数春季的变动范围为0.126~8.845,均值为1.538,秋季的变动范围为0.1321~6.351,均值为1.453。Shannon-Wiener指数春季的变动范围为0~2.686,均值为1.199,秋季的变动范围为0~2.436,均值为1.043。Pielou均匀度指数春季的变动范围为0.167~1,均值为0.644,秋季的变动范围为0.217~1,均值为0.783(附表Ⅲ,图 4)。经Mann-Whitney检验,这些指数的季节间差异均未达到显著水平(P>0.05)。

|
图 4 不同季节大型底栖无脊椎动物的生物多样性 Fig.4 Biodiversity indices of macroinvertebrates in different seasons |
采用PLSR回归模型进行了环境因子与大型底栖无脊椎动物多样性(Fisher指数、Shannon-Wiener指数和Pielou均匀度指数)之间的关系分析。由表 2可知,在春季的PLSR分析中,硅藻丰度(BaA)、绿藻丰度(ChA)和溶解氧(DO)被发现是对大型底栖无脊椎动物多样性具有重要影响的环境因子(VIP>0.8),而在秋季的PLSR分析中,除了硅藻丰度和绿藻丰度外,总氮(TN)、总磷(TP)和硝态氮(NO3--N)也被发现是对大型底栖无脊椎动物多样性具有重要影响的环境因子(VIP>0.8)。
| 表 2 用于预测大型底栖无脊椎动物多样性指标的偏最小二乘法回归模型参数汇总* Tab. 2 Summary of PLSR (Partial Least Squares Regression) model parameters used to predict biodiversity indices of macroinvertebrates |
在PLS-SEM模型中,构建了表征藻类种群状态、水体理化状态以及大型底栖无脊椎动物多样性的3个潜变量,通过路径分析探讨它们之间的关系。春季数据的分析结果(图 5A)表明,较高的藻类丰度对大型底栖无脊椎动物多样性产生了较强的负向效应(路径系数为-0.213),与此同时,较高的水体营养状态则促进了藻类丰度的增长(路径系数为0.519),抑制了大型底栖无脊椎动物多样性的提高(路径系数为-0.213);秋季数据的分析结果(图 5B)表明,较低的水体营养状态有利于藻类丰度的增长(路径系数为0.456),也有利于大型底栖无脊椎动物多样性的提高(路径系数为0.494),但过高的藻类丰度仍然不利于大型底栖无脊椎动物多样性的增长(路径系数为-0.350)。对比春季和秋季数据的SEM模型可以看出,春季水体营养盐促进了藻类丰度的增长,而秋季则是较高的水温和pH有利于藻类生长。

|
图 5 基于PLS-SEM分析的总体概念模型:(A)春季数据;(B)秋季数据。(方框为观测变量,椭圆圈为潜变量,观测变量和潜变量之间显示的是外部载荷,潜变量之间的箭头上显示的是路径系数) Fig.5 Overall conceptual models based on PLS-SEM analysis: (A) the spring data, (B) the autumn data (The rectangular boxes represent observed variables, and the oval circles represent latent variables. The arrows between observed variables and latent variables indicate the outer loadings, while the path coefficients are displayed on the arrows between latent variables) |
2010年的调查显示,江西省中小湖泊基本处于中营养-轻度富营养水平[12]。2013—2014年基于浮游植物的评价结果也表明,除赤湖处于中营养水平外,江西省的其他10个大中型浅水湖泊均处于不同程度的富营养水平[16]。本研究发现,江西省的湖泊藻类丰度平均值在春季和秋季均超过1.0×107 cells/L的水平,且秋季均值远高于春季,呈现出明显的富营养化趋势(表 1)。大型底栖无脊椎动物的分析结果表明,春季和秋季的优势种类均为典型的湖沼物种和富营养化指示种,如摇蚊属一种、长足摇蚊属一种和霍甫水丝蚓,这进一步表明江西省湖泊营养水平总体上较高。根据分类单元在湖泊水体中的出现率来看,寡毛类、水生昆虫以及软体动物是大型底栖无脊椎动物的主要类群组成。多毛类齿吻沙蚕只出现于鄱阳湖及其邻近水体,如军山湖和珠湖。这两个湖泊历史上均是鄱阳湖的组成部分,由于筑堤活动成为独立的水体[34-35],因此多毛类仍然能够在这些湖泊中存活[14-15, 34]。MRPP和SIMPER分析结果显示,江西浅水湖泊大型底栖无脊椎动物的群落结构发生明显的季节变化,是由长足摇蚊属一种、摇蚊属一种、石田螺属一种、苏氏尾鳃蚓和霍甫水丝蚓等湖沼典型种的丰度变化引起。2011—2013年的调查结果显示,江西修水流域浅水湖泊和鄱阳湖邻近水体沙湖的大型底栖无脊椎动物优势种均包括梨形石田螺(梨形环棱螺)和菱跗摇蚊,且涵盖螺类、摇蚊类和颤蚓类等类群[36-37]。本研究显示,石田螺是江西浅水湖泊中常见优势种,其在湖泊水体中的出现率为63.16%,且摇蚊类和颤蚓类的丰度变化对群落结构的季节演替具有较大影响。
历次对鄱阳湖及周边水域的调查结果显示,2007—2008年优势种为河蚬和苏氏尾鳃蚓[3],2011—2012年为淡水壳菜、梨形环棱螺、赤豆螺、中华沼螺、钩虾、寡鳃齿吻沙蚕、苏氏尾鳃蚓和前突摇蚊[5, 38],2016—2017年为淡水壳菜、河蚬、梨形石田螺、铜锈石田螺(铜锈环棱螺)、大沼螺、寡鳃齿吻沙蚕和霍甫水丝蚓[6, 9-10],2019—2020年为河蚬、梨形石田螺、寡鳃齿吻沙蚕、粗腹摇蚊和羽摇蚊[39]。由于不同研究者调查范围不尽相同,得出的大型底栖无脊椎动物优势种组成也有所不同,但一些种类进入优势种行列的概率很大,如河蚬、石田螺和寡鳃齿吻沙蚕等。蔡永久等的研究结果显示,在鄱阳湖及周边湖泊群中,鄱阳湖的优势物种为河蚬,而其他中小型湖泊则以寡毛类和摇蚊类为主导[15],孙威威的研究结果表明,鄱阳湖通江水道和主湖区以河蚬和寡鳃齿吻沙蚕为优势种,子湖区多以摇蚊幼虫为优势种[39]。本研究结果显示,鄱阳湖中河蚬的密度占比高达21.36%,其次是钩虾,占比19.58%;而在除鄱阳湖外的其他中小湖泊中,寡毛类的密度占比为18.24%,摇蚊类的密度占比为66.92%。这表明鄱阳湖优势种组成没有发生根本性的变化,而鄱阳湖周边湖泊群优势种始终以摇蚊类为主。
长江中下游的草型湖泊主要特征种类为腹足类软体动物,天然养殖湖泊主要为河蚬、寡鳃齿吻沙蚕和苏氏尾鳃蚓,而施肥养殖湖泊和城市湖泊主要为颤蚓类和摇蚊类[14]。本研究中,根据主要类群组成的分布情况来看,指示类群为软体动物的湖泊数量占比为26.32%,指示类群为水生昆虫(主要是摇蚊类)的湖泊占比为55.26%,指示类群为寡毛类的湖泊占比为18.42%。指示类群为水生昆虫和寡毛类的湖泊合计占比高达73.68%,这与绝大多数湖泊为藻型养殖湖泊的现状相吻合。闫云君等对草型湖泊和藻型湖泊的比较研究发现,草型湖泊的大型底栖无脊椎动物以刮食者为主,而藻型湖泊以收集者为主[40]。本研究中,从摄食功能群的角度来看,指示摄食类群为收集者的湖泊数量占比高达53.94%,而指示摄食类群为刮食者的湖泊占比仅为19.74%。这表明江西浅水湖泊多为藻型湖泊,草型湖泊的占比较低,丰富的沉积环境为收集者提供了理想的栖息场所。
富营养化是导致湖泊生物多样性丧失和生态系统功能退化的关键驱动因素[41-42]。基于PLSR的分析结果表明,影响大型底栖无脊椎动物多样性指标的环境因子既与藻类种群动态(如硅藻丰度、蓝藻丰度、绿藻丰度、藻类丰度)有关,也与水质状态(如总氮、氨氮、硝态氮、总磷和高锰酸盐)相关。就季节变化而言,硅藻丰度和绿藻丰度始终是影响大型底栖无脊椎动物的3个多样性指标的重要环境因子,这表明江西省湖泊中大型底栖无脊椎动物多样性与硅藻和绿藻动态之间存在较为紧密和稳定的联系。基于PLS-SEM的分析结果显示,藻类种群状态与大型底栖无脊椎动物多样性存在稳定的联系,不受季节因素的影响,过高的藻类丰度不利于大型底栖无脊椎动物多样性的提高[43]。与此同时,水体理化状态也对大型底栖无脊椎动物多样性具有不可忽视的影响,较好的水质状况有利于大型底栖无脊椎动物多样性的提高,而较差的水质状态则有抑制作用。此外,水质状态对藻类种群动态的影响具有季节性,春季营养盐占据主导作用,而秋季则是水温、pH等理化因子占主导作用。
外源营养输入过剩会对大型底栖无脊椎动物多样性产生不利影响[44-45]。在长江中下游地区的不同类型湖泊中,施肥养殖湖泊和城市湖泊中的大型底栖无脊椎动物呈现出密度高、生物量和多样性低的特征。随着湖泊水体营养水平的增加,大型底栖无脊椎动物群落结构趋于简化,并以耐污种类为主导[14]。本研究中,多数湖泊位于城镇区域,水体交换能力较差,水质相对较差,主要属于Ⅳ和Ⅴ类水体。综合利用(防洪、灌溉和渔业养殖)和单一渔业养殖湖泊占比达到84.21%。本研究发现,无论是春季还是秋季,大型底栖无脊椎动物多样性均处于较低水平,这可能与大多数湖泊伴随渔业养殖活动产生的外源营养输入过剩形成内源污染有关。暴雨引起的水位频繁变化对湿地大型底栖无脊椎动物的生存不利,暴雨后水位的升高和流量的增加会导致大型底栖无脊椎动物物种数和个体数的减少,从而影响其分布,进而导致物种多样性与降雨量呈现显著的负相关关系[46]。江西浅水湖泊在夏季洪水过后的秋季,大型底栖无脊椎动物的α多样性略低于春季,这可能是由于夏季洪水引起的水位剧增对大型底栖无脊椎动物多样性产生了一定程度的不利影响。此外,基于PLSR的分析结果显示,秋季相比春季对3项多样性指标的影响中,增加了总氮、总磷和硝态氮3项营养盐指标,而这3项指标与面源污染密切相关,可能是夏季洪水过后面源污染对湖泊大型底栖无脊椎动物多样性造成不利影响的直接体现。PLS-SEM的分析结果也清晰地表明,藻类种群动态以及水质状况对大型底栖无脊椎动物多样性具有不可忽视的影响,要提高大型底栖无脊椎动物的多样性,需要控制藻类丰度,改善水质状况。
3.2 大型底栖无脊椎动物资源保护建议本研究结果表明,江西浅水湖泊大型底栖无脊椎动物α多样性水平较低,影响大型底栖无脊椎动物多样性指标的环境因子既与藻类种群动态密切相关,也与水质状态有关。大型底栖无脊椎动物多样性与藻类种群状态存在稳定的联系,不受季节因素的影响,过高的藻类丰度不利于大型底栖无脊椎动物多样性的提高,而较好的水质状况有利于大型底栖无脊椎动物多样性的提高。在湖泊生态系统中,水生植物群落的缺失对浮游动物和大型底栖无脊椎动物的多样性具有负面效应,而对浮游植物具有正面效应[47],也就是说提高水生植物的比例有利于浮游动物和大型底栖无脊椎动物多样性的提高,同时起到抑制浮游植物的作用。为保护江西省湖泊大型底栖无脊椎动物资源,应在具有渔业养殖功能的湖泊和城镇湖泊中进行水生植物的修复工作,使藻型湖泊向草型湖泊方向演化。湖泊水体的富营养化会对大型底栖无脊椎动物的多样性造成不利影响。对中国洪泛平原浅水湖泊的研究表明,大型底栖无脊椎动物多样性指标随富营养化水平增加呈明显的下降趋势,且环境因素(与富营养化相关的水质变量)比空间因素具有更强的解释能力[21]。研究表明,富营养化导致了太湖流域湖泊大型底栖无脊椎动物多样性的丧失和群落的简化[48]。为提高江西省湖泊大型底栖无脊椎动物的多样性,应对一些富营养化程度较高的水体进行系统治理,控制面源污染,促进传统渔业养殖模型向生态渔业模式转换,并有针对性地开展一些生态修复措施。江西浅水湖泊大多数位于城镇区域,连通性较低且水体交换能力差,在控制藻类和改善水质的基础上,应增强湖泊的连通性和水体交换能力,充分发挥自然修复功效。湖泊水体营养水平及水生植被的分布是决定浅水湖泊大型底栖无脊椎动物群落结构及多样性的关键[49]。宏观尺度上,大型底栖无脊椎动物群落的时空变化主要由营养水平和栖息地质量决定,相对于浮游动植物,大型底栖无脊椎动物对湖泊环境条件的改善更敏感,这也是在湖泊生态修复持续监测中选择大型底栖无脊椎动物作为指示生物的重要原因[17, 21, 48]。因此,对江西省湖泊的大型底栖无脊椎动物进行持续调查、观测和评估可以实时反馈湖泊管理工作的成效,意义重大。在实际管理工作中,应充分发挥大型底栖无脊椎动物水体哨兵的功能,持续监测和评估大型底栖无脊椎动物优势种的变化趋势,为下一步管理对策的实施奠定依据。
4 结论1) 江西省湖泊大型底栖无脊椎动物春季和秋季的优势种类均为典型的富营养化湖泊指示种,其群落结构发生明显的季节变化,是由湖沼典型种的丰度变化引起的。
2) 指示类群为水生昆虫和寡毛类的湖泊以及指示摄食类群为收集者的湖泊数量占比较高,这与江西省绝大多数湖泊为藻型养殖湖泊,而草型湖泊较少的现状相吻合。
3) PLSR分析表明,影响大型底栖无脊椎动物多样性指标的环境因子既与藻类种群动态有关,也与水质状态相关。基于PLS-SEM的分析结果表明,藻类种群状态与大型底栖无脊椎动物多样性存在稳定的联系,不受季节因素的影响,水体理化状态也对大型底栖无脊椎动物多样性具有不可忽视的影响。
4) 富营养化引起的藻类增长,生境(阶段性氧不足)和食源变化(底泥有机碎屑)是大型底栖无脊椎动物α多样性下降的主要驱动力。
5) 为保护大型大型底栖无脊椎动物资源,应采取措施促使藻型湖泊向草型湖泊方向演化,倡导生态渔业模式,控制藻类异常增殖和改善水质,提高湖泊的连通性和水体交换能力。
5 附录附表Ⅰ~Ⅲ见电子版(DOI: 10.18307/2024.0333)。
| 附表Ⅰ 江西省76个浅水湖泊基本信息 Appendix Ⅰ Basic information of 76 shallow lakes in Jiangxi Province |
| 附表Ⅱ 江西省76个湖泊大型底栖无脊椎动物名录及密度 Appendix Ⅱ List and density of macroinvertebrates of 76 lakes in Jiangxi Province |
| 附表Ⅲ 江西省浅水湖泊的大型底栖无脊椎动物的多样性指标 Appendix Ⅲ Diversity indicators of macroinvertebrates in shallow lakes of Jiangxi Province |
| [1] |
Liu JT, Li RF. Trend analysis of water resource characters in Jiangxi Province. Jiangxi Hydraulic Science & Technology, 2013, 39(1): 61-65. [刘聚涛, 李荣昉. 江西省水资源特征变化分析. 江西水利科技, 2013, 39(1): 61-65.] |
| [2] |
Sun WW, Li K, Qin HM et al. The seasonal dynamics of macrozoobenthos in the shallow-lakes of Poyang Lake Wetland. Journal of Nanchang University: Natural Science, 2020, 44(2): 172-179. [孙威威, 李科, 秦海明等. 鄱阳湖南矶湿地碟形湖泊大型底栖动物季节动态. 南昌大学学报: 理科版, 2020, 44(2): 172-179.] |
| [3] |
Ouyang S, Zhan C, Chen TH et al. Species diversity and resource assessment of macrozoobenthos in Poyang Lake. Journal of Nanchang University: Engineering & Technology, 2009, 31(1): 9-13. [欧阳珊, 詹诚, 陈堂华等. 鄱阳湖大型底栖动物物种多样性及资源现状评价. 南昌大学学报: 工科版, 2009, 31(1): 9-13.] |
| [4] |
Zhang MH, Xu L, Xie GL et al. Species diversity, distribution and conservation of freshwater mollusk in Poyang Lake Basin. Marine Sciences, 2013, 37(8): 114-124. [张铭华, 徐亮, 谢广龙等. 鄱阳湖流域淡水贝类物种多样性、分布与保护. 海洋科学, 2013, 37(8): 114-124.] |
| [5] |
胡成龙. 鄱阳湖大型底栖动物群落结构研究[学位论文]. 抚州: 东华理工大学, 2014.
|
| [6] |
Yang CY, Zhang M, Qu XD et al. Patterns of the macroinvertebrate community in Poyang Lake and relat-ed environmental factors. Asian Journal of Ecotoxicology, 2018, 13(4): 91-100. [杨晨昱, 张敏, 渠晓东等. 鄱阳湖大型底栖动物群落结构的空间分布及影响因子研究. 生态毒理学报, 2018, 13(4): 91-100. DOI:10.7524/AJE.1673-5897.20180312001] |
| [7] |
You QH, Liu LL, Fang N et al. Assessing ecological health of Poyang Lake wetland, using benthic macroinvertebrate-based index of biotic integrity (B-IBI). Acta Ecologica Sinica, 2019, 39(18): 6631-6641. [游清徽, 刘玲玲, 方娜等. 基于大型底栖无脊椎动物完整性指数的鄱阳湖湿地生态健康评价. 生态学报, 2019, 39(18): 6631-6641. DOI:10.5846/stxb201806041248] |
| [8] |
肖晋志. 鄱阳湖国家级自然保护区及周边河流大型底栖动物群落结构及多样性研究[学位论文]. 南昌: 南昌大学, 2012.
|
| [9] |
李科. 鄱阳湖及其连通水域大型底栖动物群落时空格局[学位论文]. 南昌: 南昌大学, 2019.
|
| [10] |
雷呈. 鄱阳湖丰水期大型底栖动物群落结构及完整性评价[学位论文]. 南昌: 江西师范大学, 2020.
|
| [11] |
徐亮. 江西鄱阳湖及"五河"干流淡水贝类多样性格局及对水位变化的响应[学位论文]. 南昌: 南昌大学, 2013.
|
| [12] |
Jiang LW, Chen Y, Lin T et al. Study on trophic state assessment and its driving factors of small and medium lakes in Jiangxi Province. Journal of Environmental Engineering Technology, 2012, 2(4): 303-308. [江立文, 陈杨, 林暾等. 江西省中小型湖泊水体营养状态评价及其驱动因子研究. 环境工程技术学报, 2012, 2(4): 303-308. DOI:10.3969/j.issn.1674-991X.2012.04.047] |
| [13] |
唐涛, 彭玉, 黄开忠等. 鄱阳湖流域中小型湖泊大型底栖动物群落结构特征研究. 南昌: 中国水利学会2018学术年会, 2018.
|
| [14] |
Cai YJ, Jiang JH, Zhang L et al. Community structure and biodiversity of macrozoobenthos of typical lakes in the middle and lower reaches of the Yangtze River. J Lake Sci, 2010, 22(6): 811-819. [蔡永久, 姜加虎, 张路等. 长江中下游湖泊大型底栖动物群落结构及多样性. 湖泊科学, 2010, 22(6): 811-819. DOI:10.18307/2010.0602] |
| [15] |
Cai YJ, Jiang JH, Zhang L et al. Structure of macrozoobenthos in lakes along the Yangtze River and relationships with environmental characteristics. Acta Ecologica Sinica, 2013, 33(16): 4985-4999. [蔡永久, 姜加虎, 张路等. 长江中下游湖群大型底栖动物群落结构及影响因素. 生态学报, 2013, 33(16): 4985-4999. DOI:10.5846/stxb201205150721] |
| [16] |
杨平. 江西省大中型浅水湖泊浮游植物与富营养化的研究[学位论文]. 南昌: 江西师范大学, 2015.
|
| [17] |
Mao ZG, Cao Y, Gu XH et al. Effects of nutrient reduction and habitat heterogeneity on benthic macroinvertebrate assemblages in a large shallow eutrophic lake. Science of the Total Environment, 2023, 867: 161538. DOI:10.1016/j.scitotenv.2023.161538 |
| [18] |
Xing YC, Gao WR, Bai J et al. Applications of environmental DNA in lake biodiversity. Acta Hydrobiologica Sinica, 2022, 46(1): 137-148. [邢迎春, 高婉茹, 白洁等. 环境DNA在湖泊生物多样性研究中的应用. 水生生物学报, 2022, 46(1): 137-148. DOI:10.7541/2021.2020.237] |
| [19] |
Dou QM, Du X, Cong YF et al. Influence of environmental variables on macroinvertebrate community structure in Lianhuan Lake. Ecology and Evolution, 2022, 12(2): e8553. DOI:10.1002/ece3.8553 |
| [20] |
Zhang ZY, Wang Z, Zhang ZH et al. Effects of engineered application of Eichhornia crassipes on the benthic macroinvertebrate diversity in Lake Dianchi, an ultra-eutrophic lake in China. Environmental Science and Pollution Research, 2016, 23(9): 8388-8397. DOI:10.1007/s11356-016-6080-z |
| [21] |
Jiang XM, Sun X, Alahuhta J et al. Responses of multiple facets of macroinvertebrate alpha diversity to eutrophication in floodplain lakes. Environmental Pollution, 2022, 306: 119410. DOI:10.1016/j.envpol.2022.119410 |
| [22] |
Morse JC, Yang L, Tian L. Aquatic insects of China useful for monitoring water quality. Nanjing: Hohai University Press, 1994.
|
| [23] |
王洪铸. 中国小蚓类研究: 附中国南极长城站附近地区两新种. 北京: 高等教育出版社, 2002.
|
| [24] |
刘月英. 中国经济动物志-淡水软体动物. 北京: 科学出版社, 1979.
|
| [25] |
国家环境保护总局, 水和废水监测分析方法编委会编. 水和废水监测分析方法(第4版). 北京: 中国环境科学出版社, 2002.
|
| [26] |
Wei ZB, Chai Y, Luo JB et al. Seasonal succession and ecological niche analysis of the dominant species of phytoplankton in Changhu Lake. Acta Hydrobiologica Sinica, 2020, 44(3): 612-621. [魏志兵, 柴毅, 罗静波等. 长湖浮游植物优势种季节演替及生态位分析. 水生生物学报, 2020, 44(3): 612-621. DOI:10.7541/2020.075] |
| [27] |
Mccune B, Mefford MJ. PC-ORD. Multivariate Analysis of Ecological Data. Version 5. Gleneden Beach: MjM Software, 2006.
|
| [28] |
Hammer ∅, Harper D, Ryan P. PAST: Palaeontological statistics software package for education and data analysis. Palaeontologia Electronica, 2001, 4(1): 1-9. |
| [29] |
Sun J, Liu DY. The application of diversity indices in marine phytoplankton studies. Acta Oceanologica Sinica, 2004, 26(1): 62-75. [孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用. 海洋学报, 2004, 26(1): 62-75.] |
| [30] |
Vanacker M, Wezel A, Payet V et al. Determining tipping points in aquatic ecosystems: The case of biodiversity and chlorophyll a relations in fish pond systems. Ecological Indicators, 2015, 52: 184-193. DOI:10.1016/j.ecolind.2014.12.011 |
| [31] |
Cummins KW, Merritt RW, Andrade PC. The use of invertebrate functional groups to characterize ecosystem attributes in selected streams and rivers in South Brazil. Studies on Neotropical Fauna and Environment, 2005, 40(1): 69. DOI:10.1080/01650520400025720 |
| [32] |
Barbour M, Gerritsen J, Snyder B et al. Rapid bioassessment protocols for use in streams and wadable rivers: Periphyton, benthic invertebrates and fish. Washington, DC: USEPA, 1999.
|
| [33] |
Mandaville S. Benthic Macroinvertebrates in Freshwaters-Taxa Tolerance Values, Metrics, and Protocols. Project H-1, Soil & Water Conservation Society of Metro Halifax, 2002. https://www.chebucto.ns.ca/science/SWCS/H-1/tolerance.pdf.
|
| [34] |
Zhang HX, Fu HY, Zhang YP et al. Community structure and distribution in space and time of benthic animals in Junshan Lake. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(3): 544-549. [章海鑫, 付辉云, 张艳萍等. 军山湖底栖动物种群结构与时空分布. 江西农业大学学报, 2015, 37(3): 544-549. DOI:10.13836/j.jjau.2015084] |
| [35] |
周慜, 何亮, 黄建美. 鄱阳湖-珠湖浮游植物群落结构时空变化特征与环境因子的关系. 生态科学, 2021(4): 36-46. |
| [36] |
刘息冕. 鄱阳湖自然保护区沙湖大型底栖动物群落结构及其影响因子研究[学位论文]. 南昌: 南昌大学, 2013.
|
| [37] |
曾旻. 修河上、下游典型水体大型底栖动物群落结构[学位论文]. 南昌: 南昌大学, 2015.
|
| [38] |
肖晋志. 鄱阳湖国家级自然保护区及周边河流大型底栖动物群落结构及多样性研究[学位论文]. 南昌: 南昌大学, 2012.
|
| [39] |
孙威威. 鄱阳湖不同渔业生境大型底栖动物群落特征研究[学位论文]. 南昌: 南昌大学, 2020.
|
| [40] |
Yan YJ, Li XY, Liang YL. A comparative study on community structure ofmacrozoobenthos between macrophtic and algal lakes. J Lake Sci, 2005, 17(2): 176-182. [闫云君, 李晓宇, 梁彦龄. 草型湖泊和藻型湖泊中大型底栖动物群落结构的比较. 湖泊科学, 2005, 17(2): 176-182. DOI:10.18307/2005.0214] |
| [41] |
Karatayev VA, Karatayev AY, Burlakova LE et al. Eutrophication and Dreissena invasion as drivers of biodiversity: A century of change in the mollusc community of Oneida Lake. PLoS One, 2014, 9(7): e101388. DOI:10.1371/journal.pone.0101388 |
| [42] |
Yuan GX, Sun LJ, Guo PQ et al. How eutrophication promotes exotic aquatic plant invasion in the lake littoral zone?. Environmental Science & Technology, 2023, 57(21): 8002-8014. DOI:10.1021/acs.est.2c09486 |
| [43] |
Gong ZJ, Xie P, Tang HJ et al. The influence of eutrophycation upon community structure and biodiversity of macrozoobenthos. Acta Hydrobiologica Sinica, 2001, 25(3): 210-216. [龚志军, 谢平, 唐汇涓等. 水体富营养化对大型底栖动物群落结构及多样性的影响. 水生生物学报, 2001, 25(3): 210-216.] |
| [44] |
Peralta EM, Batucan LS, De Jesus IBB et al. Nutrient loadings and deforestation decrease benthic macroinvertebrate diversity in an urbanised tropical stream system. Limnologica, 2020, 80: 125744. DOI:10.1016/j.limno.2019.125744 |
| [45] |
O'Callaghan P, Jocqué M, Kelly-Quinn M. Nutrient- and sediment-induced macroinvertebrate drift in Honduran cloud forest streams. Hydrobiologia, 2015, 758(1): 75-86. DOI:10.1007/s10750-015-2271-8 |
| [46] |
Kim HG, Lee DJ, Yoon CS et al. Assessing biodiversity of benthic macroinvertebrates and influences of several environmental factors on the community structure in upo wetland by long-term ecological monitoring. Journal of Environmental Science International, 2016, 25(4): 459-472. DOI:10.5322/jesi.2016.25.4.459 |
| [47] |
Misteli B, Pannard A, Aasland E et al. Short-term effects of macrophyte removal on aquatic biodiversity in rivers and lakes. Journal of Environmental Management, 2023, 325: 116442. DOI:10.1016/j.jenvman.2022.116442 |
| [48] |
Wang H, GarcíaMolinos J, Heino J et al. Eutrophication causes invertebrate biodiversity loss and decreases cross-taxon congruence across anthropogenically-disturbed lakes. Environment International, 2021, 153: 106494. DOI:10.1016/j.envint.2021.106494 |
| [49] |
胡志新. 不同生态类型湖泊生物多样性和湖泊分类方法研究[学位论文]. 南京: 南京大学, 2014.
|
 2024, Vol. 36
2024, Vol. 36 

