目前,我国绝大部分湖泊处于中营养或富营养水平,氮、磷营养盐超标导致的富营养化已成为当前我国湖泊面临的主要生态环境问题之一[1-3]。近几十年来,我国不同营养状态的大型重点湖泊如太湖、巢湖、滇池等蓝藻水华频发[4-6]。受人为调蓄影响,水库通常水动力条件相对较弱、自净能力较差,更易导致营养盐累积并引发富营养化现象,藻类水华已成为水库面临的主要生态挑战[7]。水华暴发可导致水中有机物、色度大幅提高,嗅味异常,藻体及其分泌物(藻毒素等)增加了水处理难度,提高了消毒副产物的生成量,严重威胁水源水库的供水安全[8]。因此,探究水源水库水华暴发成因并开展污染物溯源研究,对于保障供水安全具有重要的科学意义。
水源水库藻类异常增殖或水华的发生受营养盐与水文气象因素共同驱动。国际公认的湖泊水华暴发总氮(TN)和总磷(TP)阈值分别为0.5~1.2和0.03~0.10 mg/L[9],浅水型富营养化湖泊水华暴发的TN和TP阈值分别为0.8和0.05 mg/L[10],当TN和TP浓度分别超过0.8和0.2 mg/L时,水华暴发不受营养盐浓度限制[11];最新针对太湖的研究表明,太湖水华暴发的TP和TN控制阈值分别为0.05~0.06和1.71~1.72 mg/L[5]。水文气象因子(温度、降雨、风速、光照、水动力条件)对湖库藻类水华的影响也极为关键[12]。针对太湖的研究表明,即使氮磷浓度控制在水华暴发的氮磷阈值水平之下,但在气象水文等因素适宜条件下,蓝藻水华发生的风险仍然较高[5];蓝藻生长繁殖的适宜温度范围为28~35℃,蓝藻水华发生的最佳温度为30℃,持续低水位或水位快速波动过程中藻类水华暴发风险较高[7];暴雨径流脉冲式输入的营养盐也可能促进水华暴发[13]。
此外,营养盐浓度比也可影响藻类生长及暴发。一项针对全球573个湖泊的研究表明,当总磷与总氮质量浓度比(TP/TN)>1∶9,藻类生长表现为“氮限制”;当1∶22.6 < TP/TN≤1∶9,表现为“氮、磷共同限制”;当TP/TN≤1∶22.6,表现为“磷限制”[14]。太湖春、冬季水体TP/TN和溶解性总磷与溶解性总氮质量浓度比(TDP/TDN)均较低(1∶80~1∶33和1∶212~1∶52),藻类生长表现为“磷限制”,磷浓度增加可显著促进藻类生长;而在夏、秋季蓝藻暴发期,水体TP/TN和TDP/TDN均高于1∶20,藻类生长表现为“氮限制”,氮浓度增加可显著促进藻类生长,因此在蓝藻易暴发的夏、秋季,总氮输入量是太湖蓝藻暴发的关键影响因子[11]。鄱阳湖固氮蓝藻暴发的TP/TN阈值为1∶20,磷酸盐与溶解态无机氮质量浓度比(PO43-/DIN)阈值为1∶40[15]。
对于湖泊(水库)富营养化防控,首先需甄别污染物的主要来源。稳定同位素示踪技术是目前开展环境水体氮溯源研究最有效的技术手段之一。1971年,氮稳定同位素(δ15N)首次被用于研究化肥对河流水体NO3--N的贡献[16]。此后,大量学者对不同氮源δ15N值域[17]及不同环境介质中氮的δ15N值域[18]进行了报道。其中,化肥中的氮主要来源为大气中的氮气,通过工业固氮(哈伯-博施法)转化而来,其δ15N值域为-6 ‰ ~+6 ‰;大气沉降来源的氮受复杂的光化学反应影响,且存在汽车尾气氮氧化物(NOX)和地表氨挥发等各种氮源贡献,其δ15N值域较宽(-13 ‰ ~13 ‰);人畜粪便与生活污水由于存放、处理及应用中的同位素分馏效应,其δ15N值域较高(4 ‰ ~25 ‰);土壤氮受动植物残体有机质矿化、硝化作用综合影响,其δ15N值域为0 ‰ ~+8 ‰。进一步,结合硝酸盐氧稳定同位素(δ18O),可有效区分大气沉降来源的氮和陆地生态系统来源的氮[19]。
鄱阳湖流域是2020年颁布的《中华人民共和国长江保护法》提出的实施生态环境修复重点流域之一。近年来,受极端气候影响,流域内汛期洪水、枯水期水资源短缺现象严重,水源水库已成为保障流域内用水安全的重要工程举措。针对水源水库富营养化及水华暴发等问题,本文选择鄱阳湖流域典型水源水库——赣江水系吉安市某水库为研究对象,重点开展了水华暴发成因及氮污染溯源研究,研究成果可为水源水库水华防控、水质安全保障提供科学依据。
1 材料与方法 1.1 研究区域与采样方法本文研究的水源水库位于赣江水系土龙河,坝址以上控制流域面积16.2 km2,总库容385万m3,水库水面面积约为23 hm2,水深3~10 m,是一座以供水、灌溉为主,兼顾防洪、发电和养殖等综合利用的小(一)型水库。水库位于亚热带季风气候区,一年四季分明,气候温和,降水丰沛。多年平均气温18℃,最高气温一般出现在7—8月份,最冷月份为1—2月;多年平均降水量1400 mm,降水量年内分配不均匀,汛期3—7月间降水量占全年的62.3%,主汛期4—6月降水量占全年的45%,10月-次年2月降水量仅占全年的19.7%。
水库上游汇水区域多为山丘区,现存两个村庄,农村居民人口约为200人;水库上游汇水区现有约510亩农田,主要为稻田和少量菜地;此外水库上游有25 hm2人造林地,存在水土流失风险。水库现有养殖为不投料清水养殖,流域内无企业,无规模化畜禽养殖,水库三面环山,植被覆盖率高,库区水质多年持续保持优良水平。此外,根据现场调研得知,受疫情影响2020年农村外出务工人员减少,早稻种植面积相较于往年增加了一倍左右。
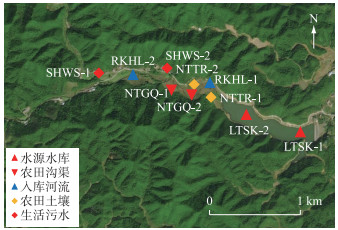
2020年8月,对水库及其周边污染源进行采样,采样点位置如图 1所示。采样期间,利用手持声呐便携式水深测探仪(日本海马,HONDEX PS-7)测定坝前和库尾处水深,由于2020年6月鄱阳湖流域极端降雨,为满足防洪需求,采样期间水库保持低水位运行,蓄水量仅为设计库容量的1/2左右,因此水深较浅,坝前和库尾水深仅分别为6.5和3.2 m。现场利用水温计(河北精创,WGQ-17)测定坝前水面以下0.5 m、中间层和库底以上0.5 m水温,分别为32.0、30.6和29.8℃,表明坝前水温随深度呈现降低趋势,但是无明显温跃层。因此,本文对水库表层(0.5 m)水体开展采样,共布设采样点2个,分别位于库尾附近、坝址(取水口附近),每个采样点采集3个平行水样。此外,在上游入库河流布设水体采样点2个,农田沟渠水体采样点2个,生活污水采样点2个,农田土壤采样点2个,每个采样点均采集3个平行样。
|
图 1 水源水库及其周边污染源采样点空间分布 (LTSK代表水库采样点,RKHL代表入库河流采样点,NTGQ代表农田沟渠采样点,NTTR代表农田土壤采样点,SHWS代表生活污水采样点) Fig.1 Spatial distribution of sampling sites in drinking water source reservoir and its surrounding pollution sources (LTSK represents drinking water source reservoir, RKHL represents inflow streams, NTGQ represents farmland ditch, NTTR represents farmland soil, SHWS represents domestic sewage) |
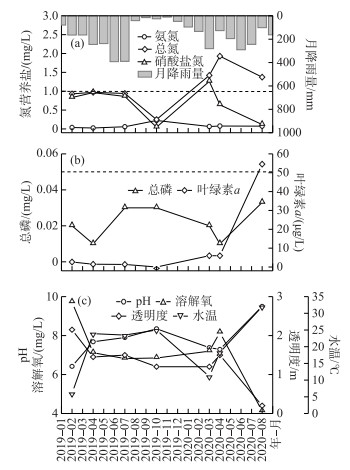
为了分析水库水质演变规律,从当地生态环境部门收集了2019—2020年4月水库历史水质监测数据,监测点位于坝前取水口处(与2020年8月采样点LTSK-1重合),采样深度为水面以下0.5 m,监测因子包括《地表水环境质量标准》(GB 3838—2002)基本项目24项、集中式生活饮用水地表水源地补充项目5项,以及透明度、叶绿素a共计31项指标。针对本文研究内容,选取历史监测数据中的pH、溶解氧、透明度、水温、总氮、硝酸盐氮、氨氮、总磷、叶绿素a、化学需氧量等指标进行分析。由于水源水库监测频次为每季度监测1次,因此共收集到2019年2、4、7、10月以及2020年3月和4月水质历史监测数据。以上历史水质参数测定参考《地表水环境质量标准》(GB 3838—2002)中规定的方法,与2020年8月采样监测方法一致,可保证数据方法的连贯性。此外,为分析降雨过程对水库水质及水华的影响,参照《吉安市水资源公报》(2019、2020年),收集了研究期间逐月降雨量数据,具体如图 2a所示。
|
图 2 水库2019—2020年水质演变特征 ((a)、(b)图中黑色水平虚线分别代表《地表水环境质量标准》(GB 3838—2002)湖库Ⅲ类水总氮、总磷限值) Fig.2 Water quality variation in the drinking water source reservoir during 2019-2020 (Black horizontal dashed lines in figure (a) and (b) represent limit of TN and TP of Class Ⅲ in lakes and reservoirs in "Environmental quality standards for surface water"(GB 3838-2002)) |
水体常规理化指标均采用国标法测定,参照《水和废水监测分析方法》(2002版),其中水样总磷(TP)浓度测定采用钼酸铵分光光度法,总氮(TN)浓度测定采用改进的碱性过硫酸钾消解紫外分光光度法,氨氮(NH3-N)浓度的测定采用纳氏试剂分光光度法,硝酸盐氮(NO3--N)浓度的测定采用紫外分光光度法,亚硝酸盐氮(NO2--N)浓度采用盐酸萘乙二胺分光光度法测定,透明度采用塞氏盘法测定,叶绿素a浓度采用热乙醇提取-分光光度法测定[20]。
对于土壤样品,自然风干、研磨、过60目筛后,分别采用氯化钾溶液提取-分光光度法[21]测定NH3-N、NO2--N、NO3--N含量;土壤TP含量采用碱熔-钼锑抗分光光度法测定,TN含量测定采用凯式定氮法。
1.3.2 硝酸盐氮、氧稳定同位素测试方法硝酸盐氮、氧同位素(δ15N-NO3-和δ18O-NO3-)利用改进的反硝化细菌法[22]测试,基本过程为根据水样中NO3--N浓度取适量水样(含50 nmol NO3--N),利用缺乏N2O还原酶活性的反硝化细菌将硝酸盐转化为N2O,产生的N2O气体利用He载气携带至Trace Gas Pre-concentrator-MAT253测试δ15N-NO3-和δ18O-NO3-,每个样品测试3次,δ15N-NO3-和δ18O-NO3-的测量误差不超过0.3 ‰和0.5 ‰。校正空白之后利用国际参考物质USGS-32、USGS-34、USGS-35和IAEA-N3进行校正,校正后的δ15N-NO3-和δ18O-NO3-分别以大气N2和V-SMOW标准化。同位素比值结果表达如式(1):
| $ \mathtt{δ}(\%)=\frac{R_{\text {sample }}-R_{\text {standard }}}{R_{\text {sample }}} \times 1000 $ | (1) |
式中,δ表示N、O同位素千分值,R=15N/14N或18O/16O,氮同位素以大气中N2平均值为标准,氧同位素以V-SMOW为标准,1000为换算系数。
1.3.3 氮同位素溯源计算方法由于水库硝酸盐潜在来源超过3种,常规的同位素质量均衡模型无法定量评估超过3种氮源的贡献率[23]。因此,本文采用Parnell等[24]开发的基于贝叶斯框架的稳定同位素分析模型(SIAR),该模型可解析3种以上氮源的负荷贡献率,并考虑了氮源同位素时空差异性及同位素分馏效应对氮源同位素的影响,具体如式(2)所示。
| $ \begin{aligned} X_{i j} & =\sum\limits_{k=1}^K P_k\left(S_{j k}+c_{j k}\right)+\varepsilon_{i j} \\ s_{j k} & \sim N\left(\mu_{j k}, \omega_{j k}^2\right) \\ c_{j k} & \sim N\left(\lambda_{j k}, \tau_{j k}^2\right) \\ \varepsilon_{j k} & \sim N\left(0, \sigma_{j k}^2\right) \end{aligned} $ | (2) |
式中,Xij为环境样品i中j同位素(‰);Pk为污染源k的贡献率(%);Sjk为污染源k中j的同位素(‰),本文参照实测值和文献报道值;cjk为污染源k中j同位素富集系数(‰);εij为模型残差(‰)。
1.3.4 统计分析方法采用SPSS 13.0软件对水华暴发期、无水华期水库理化指标差异性和显著性进行分析(独立样本t检验),数据结果利用Origin 2021软件作图分析,并利用Origin 2021软件对叶绿素a浓度与环境因子、降雨量进行Pearson相关性分析和显著性检验分析。数据均经过转换使之符合统计分析的要求,采用非限制性蒙特卡罗排列迭代计算方法,对统计结果的显著性进行验证(双尾检验)。其中,P < 0.05为显著,P < 0.01为极显著。
2 结果 2.1 水库水环境现状根据2020年8月监测结果可知,由于水库面积较小、采样期间水库保持低水位运行,水深较浅,总体上库尾和坝前2个表层水体监测点位水质理化参数差异较小(标准差 < 10%,附表Ⅰ),坝前叶绿素a浓度(60.27 mg/m3)略高于库尾(48.8 mg/m3),可能原因为受水流影响,浮游藻体在坝前相对聚集。取2020年8月2个点位水质参数的平均值,与历史监测数据(2019年2、4、7、10月及2020年3、4月)进行水质变化规律分析,结果如图 2所示。2020年8月水华暴发期,水库TN、叶绿素a浓度显著高于无水华期,水体透明度显著低于无水华期(P < 0.05,t检验)。其中,TN浓度由0.25~0.97 mg/L升高至1.37~1.42 mg/L,超过《地表水环境质量标准》(GB 3838—2002)Ⅲ类水TN限值标准(1 mg/L);叶绿素a浓度由0.01~2.66 μg/L升高至6.00~54.54 μg/L,表明浮游植物密度有逐年升高的趋势;受8月份水华暴发影响,透明度由1.20~2.15 m降低至0.2 m(图 2)。
此外,水库表层水TP、NH3-N、NO3--N、DO等水化学指标无显著性年际升高趋势(P>0.05)。其中,TP、NH3-N、NO3--N和DO浓度分别为0.01~0.033、0.025~0.224、0.045~1.26和6.82~9.72 mg/L,均不超过《地表水环境质量标准》(GB 3838—2002)湖库Ⅲ类水限值标准。
2.2 水库水体硝酸盐氮氧同位素组成特征水库水体δ15N-NO3-和δ18O-NO3-均值分别为1.9 ‰和19.3 ‰;水库上游入库河流水体δ15N-NO3-和δ18O-NO3-相对较低,均值分别为6.7 ‰和2.5 ‰;周边农田沟渠水体δ15N-NO3-和δ18O-NO3-均值分别为5.2 ‰和7.7 ‰;生活污水δ15N-NO3-和δ18O-NO3-较高,分别为15.8 ‰和10.7 ‰;农田土壤δ15N-NO3-和δ18O-NO3-值最低,分别为-5.1 ‰和4.5 ‰。本研究中,生活污水与农田土壤氮同位素值位于文献报道的污水(4 ‰ ~25 ‰)与土壤氮(0 ‰ ~8 ‰)同位素值域范围[18]内,且水库水体与不同污染来源(入库河流水体、农田沟渠、生活污水、农田土壤等)δ15N-NO3-和δ18O-NO3-差异明显,表明利用氮、氧稳定同位素示踪开展氮污染溯源分析在本研究中是可行的。
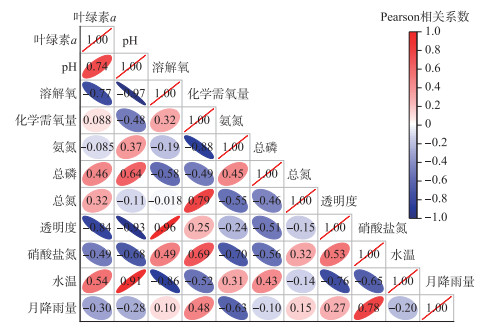
3 讨论 3.1 水源水库水华暴发成因分析水环境因子(总氮、总磷、pH、溶解氧、温度)是影响水华暴发的关键性因素[4],藻类生长繁殖的适宜温度范围为28~35℃,藻类水华发生的最佳温度为30℃,持续低水位或水位快速波动会增加水华暴发的风险[7]。前人研究表明,在水华暴发关键期,叶绿素a浓度显著升高,是表征水华的重要指标[25]。本研究中,叶绿素a与TP、TN、水温呈正相关(r=0.46、0.32、0.54),与溶解氧、透明度呈显著负相关(r=-0.77、-0.84,P < 0.05),与月降雨量呈负相关(r=-0.30,图 3)。以上结果表明,2019年,采样期间水库水温相对较低(6~25℃),TP、TN浓度较低(平均浓度分别为0.023和0.77 mg/L),抑制了藻类的大量生长繁殖;2020年8月,受夏季高温影响,水库水温升高至32℃(图 2),TP、TN浓度分别升高至0.033和1.37 mg/L,适宜藻类大量生长繁殖,并促进水华暴发。此外,2020年6月,鄱阳湖流域经历了极端洪水过程,为了防洪安全,水库提前泄洪保持低水位运行,加之水华暴发期间降雨量偏少(图 2a),受水库下游农业、旅游业取用水量增加等多重因素综合影响,水库蓄水量(190万m3)仅为设计库容量的一半,持续的低水位进一步增加了水华暴发风险。
|
图 3 叶绿素a浓度与环境因子相关性热图 Fig.3 Heat map of correlation between chlorophyll-a concentration and environmental factors |
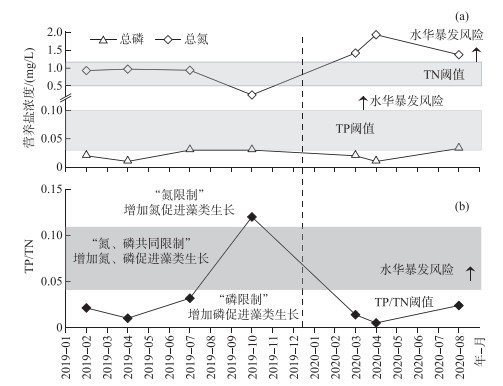
由水库历史水质监测数据和2020年8月补充监测数据(图 4)可知,2019年水库TN和TP浓度均较低,均值分别为0.77 mg/L(0.25~0.97 mg/L)和0.023 mg/L(0.01~0.03 mg/L),均不超过国际公认的水华暴发TN阈值(0.5~1.2 mg/L)和TP阈值(0.03~0.10 mg/L)范围[9, 11];加之研究期间水温相对较低(6~25℃),较低的氮、磷营养盐浓度和低温不利于藻类的大量生长暴发。2020年水库水体TN平均浓度为1.57 mg/L(1.37~1.93 mg/L),相比于2019年显著升高了1.04倍(P < 0.05),3次TN监测结果均高于水华暴发TN阈值(图 4a);2020年TP平均浓度为0.021 mg/L(0.01~0.033 mg/L),相比于2019年无显著变化,且基本不超过水华暴发TP浓度阈值(图 4a),据此推断2020年TN浓度升高是水库水华暴发的重要原因之一。
|
图 4 2019—2020年水库TP、TN、TP/TN实测数据与文献报道水华暴发阈值对比 (图(a)中灰色方框分别表示文献报道的水华暴发TP阈值(0.03~0.1 mg/L)和TN阈值(0.5~1.2 mg/L);图(b)中不同区域由下至上分别代表“磷限制”、“氮、磷同时限制”和“氮限制”的TP/TN阈值) Fig.4 Comparison of the measured TP, TN and TP/TN in drinking water source reservoir during 2019-2020 with the literature reported thresholds of algal bloom (The grey boxes in figure (a) represent the TP threshold (0.03-0.1 mg/L) and TN threshold (0.5-1.2 mg/L), and the bottom-up different color areas in figure (b) represent TP/TN thresholds of "P limit", "N and P simultaneously limit", and "N limit", respectively) |
进一步,对水库TP/TN比值特征进行分析。2019年前3个季度,TP/TN比值为1∶97~1∶31,均低于文献报道的水华暴发TP/TN阈值(~1∶22.6),据此推断水库藻类生长处于“磷限制”阶段,由于同时期水库TP浓度维持在较低水平,限制了水华暴发。2019年10月,由于TN浓度降低(0.25 mg/L),TP/TN急剧升高至1∶8.3,远高于鄱阳湖水华暴发阈值(1∶20),参照Qin等[14]研究结果,此时水库藻类生长处于“氮限制”阶段。2020年水库TN浓度相比于2019年显著升高(P < 0.05),TP/TN比值为1∶71~1∶42,此时藻类生长处于“磷限制”。
综上,2019年较低的氮、磷营养盐浓度和相对低温不利于藻类的大量生长暴发,水库藻类生长处于“氮磷共同限制”;2020年,库区水体TN浓度显著升高,加之夏季高温、库区蓄水量低,是导致2020年8月水库水华暴发的主要成因,此时藻类生长处于“磷限制”。
3.2 水库氮污染物赋存及形态转化根据2019—2020年不同时期水库表层水TN构成特征及其赋存形态变化(图 5a),探讨水华暴发期水体主要氮转化途径。2019年NO3--N是水库最主要的氮赋存形态(10月除外),其占比高达89.7% ~97.5%;其次为NH3-N,占比2.53% ~6.17%;有机氮含量最低,仅占0~6.24%。与之对比,2020年水库有机氮含量逐月升高,占比由3月的6.67% 提升至8月的86.09%;NO3--N浓度急剧降低,由3月的88.73% 降低至8.52%;NH3-N均维持在较低水平(3.99% ~5.39%)。此外,由水库TN构成年际变化趋势(图 5b)可知,受藻类同化吸收作用影响,水库TN主要构成由无机态的NO3--N转化为藻类生物有机氮[26]。
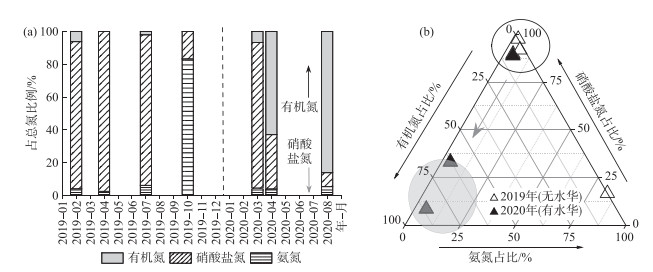
|
图 5 水库表层水氮赋存特征(a)和水库表层水TN构成年际变化趋势(b) Fig.5 Nitrogen occurrence in surface water of the drinking water source reservoir(a), and the interannual variation of nitrogen occurrence in the surface water of the drinking water source reservoir(b) |
以上分析结果表明,水华暴发期间水库TN的赋存形态发生了显著改变,无水华期TN主要形态为NO3--N (占比>90%),水华暴发期TN主要形态为有机氮(占比86%)。导致TN形态转化的主要原因为藻类同化吸收NO3--N,转化为藻类生物体有机氮。
3.3 水库氮污染同位素溯源研究由于无水华期水库TN主要构成为NO3--N(占比>90%);有机氮、NH3-N和NO2--N浓度很低(占比 < 5%、< 5% 和 < 1%)。因此,进一步利用δ15N-NO3-和δ18O-NO3-示踪技术,开展水库NO3--N溯源研究。
由于采样期间2020年8月为水库水华暴发期,前文分析结果显示,水华暴发期水库表层水TN主要赋存形态由NO3--N(>90%)转化为有机氮(86%),主要氮转化过程为藻类同化吸收,与前人在淀山湖研究结果基本一致[26]。因此,本文进一步分析藻类同化过程对水体硝酸盐氮、氧同位素分馏的影响;水库上游河流及污染源不受藻类影响,且山区河流、沟渠汇流过程快,水力停留时间短,忽略氮转化过程对硝酸盐氮、氧同位素分馏影响。前人针对海洋浮游植物和藻类细胞的室内培养研究表明,藻类同化导致的硝酸盐氮、氧同位素富集系数(15ε、18ε)近似相等(18ε: 15ε≈1),藻类细胞的15ε约为2.2 ‰ ~5.1 ‰ [27-28]。因此,本文参照以上研究成果,评估藻类对水库表层水硝酸盐氮、氧同位素分馏的影响。由于研究水库受闸坝控制,水环境系统相对封闭,藻类对硝酸盐同化过程的同位素分馏效应可采用瑞利同位素分馏模型[27]来描述,具体如式(3)所示:
| $ \begin{aligned} & \mathtt{δ}^{15} \mathrm{~N}_{\text {水华暴发期 }}=\mathtt{δ}^{15} \mathrm{~N}_{\text {无水华期 }}-{ }^{15} \varepsilon \ln \frac{\left[\mathrm{NO}_3^{-}\right]_{\text {水华暴发期 }}}{\left[\mathrm{NO}_3^{-}\right]_{\text {无水华期 }}} \\ & \mathtt{δ}^{18} \mathrm{O}_{\text {水华暴发期 }}=\mathtt{δ}^{18} \mathrm{O}_{\text {无水华期 }}-{ }^{18} \varepsilon \ln \frac{\left[\mathrm{NO}_3^{-}\right]_{\text {水华暴发期 }}}{\left[\mathrm{NO}_3^{-}\right]_{\text {无水华期 }}} \end{aligned} $ | (3) |
式中,δ15N水华暴发期和δ18O水华暴发期分别代表水华暴发期(2020年8月)硝酸盐氮、氧稳定同位素(‰),均值为1.92 ‰和19.25 ‰;δ15N无水华期和δ18O无水华期分别代表无水华期硝酸盐氮、氧稳定同位素(‰);15ε和18ε分别代表藻类同化过程中硝酸盐氮、氧稳定同位素富集系数(‰),取文献报道的藻类细胞室内培养结果的均值3.86 ‰ [27];[NO3-]水华暴发期和[NO3-]无水华期分别为水华暴发期和无水华期水库表层水NO3--N浓度(mg/L),[NO3-]水华暴发期为0.117 mg/L(2020年8月),选取距水华暴发期最近的一次无水华期(2020年4月)为同位素瑞利分馏模型中的无水华期,因此[NO3-]无水华期为0.639 mg/L。
根据瑞利同位素分馏模型拟合结果(图 6a),估算得出水库无水华期δ15N无水华期和δ18O无水华期均值分别为-4.56 ‰和12.77 ‰。水华暴发期,藻类同化作用导致氮、氧同位素富集了6.48 ‰,δ15N水华暴发期和δ18O水华暴发期均值分别升高为1.92 ‰和19.25 ‰ (图 6b)。
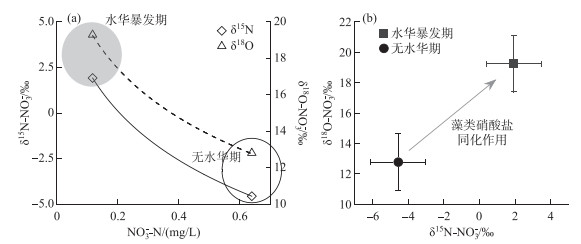
|
图 6 藻类同化作用对水库NO3-氮、氧同位素的影响 Fig.6 Effect of algal assimilation on nitrogen and oxygen isotopes of nitrate in surface water of the drinking water source reservoir |
对比分析无水华期、水华暴发期水库及主要污染源δ15N-NO3-、δ18O-NO3-关系(图 7)可知,无水华期水库表层水δ15N-NO3-、δ18O-NO3-主要位于农业化肥同位素值域范围内,推断水库表层水NO3--N主要来源于农业氮肥流失;水库上游径流δ15N-NO3-和δ18O-NO3-位于文献报道的土壤氮同位素值域内[29],推断8月水库上游径流携带的NO3--N主要来源于上游农田土壤氮淋失;稻田土壤δ15N-NO3-和δ18O-NO3-较低,位于农业氮肥同位素值域内,表明稻田土壤NO3--N主要来源于农业氮肥;稻田径流δ15N-NO3-和δ18O-NO3-位于土壤氮同位素值域内;生活污水δ15N-NO3-较高(15.3 ‰ ~16.2 ‰),位于文献报道的生活/畜禽污水同位素值域内[29]。
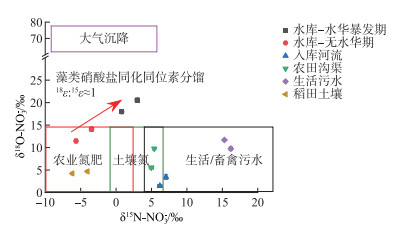
|
图 7 水库表层水、入库河流、农田沟渠、稻田土壤、生活污水δ15N-NO3-、δ18O-NO3-分布 (红色、绿色、黑色、紫色方框分别代表文献报道的农业氮肥、土壤氮、生活/畜禽污水和大气沉降δ15N-NO3-、δ18O-NO3-值域[29],红色箭头代表藻类硝酸盐同化过程中硝酸盐18O和15N同位素富集系数比值(1∶1)) Fig.7 δ15N-NO3- and δ18O-NO3- in the surface water of drinking water source reservoir, inflow streams, farmland ditch, paddy soil, and domestic sewage (The red, green, black, and purple boxes represent the δ15N-NO3- and δ18O-NO3- values of agricultural nitrogen fertilizer, soil nitrogen, domestic/livestock sewage, and atmospheric precipitation reported from the literature[29], respectively. The red arrow represents the ratios of nitrate 18O and 15N isotopes enrichment coefficient (1∶1) during algae nitrate assimilation process) |
进一步,利用SIAR模型,定量评估不同污染源对水库表层水NO3--N的负荷贡献率,模型运行结果如表 1所示。SIAR模型迭代运算30000次以后,模型残差较低(0.03% ~0.14%),表明模型具有较好的模拟精度。
| 表 1 SIAR模型模拟结果及模型相关输出参数 Tab. 1 The simulation results and output parameters of SIAR model |
根据不同污染源对水库NO3--N负荷贡献率(图 8),可知水库NO3--N主要来源于上游稻田施用的氮肥流失,其负荷贡献率高达64.45%;其次为水库上游山区土壤氮流失和大气沉降,其负荷贡献率分别为14.08% 和12.35%;生活污水负荷贡献率较低,仅为9.12%。由于水华暴发前NO3--N是水库表层水TN的主要赋存形态,其占TN比例均值超过90%,NO3--N来源可代表氮污染总体来源。因此,水库预防水华暴发TN优先控制污染源为上游稻田流失的氮肥。

|
图 8 水库表层水NO3--N主要来源及其负荷贡献率 Fig.8 Contribution of main sources to NO3--N in surface water of the drinking water source reservoir |
根据研究区域农业种植特征和降雨特征分析可知,水库上游早稻田施肥量及施肥时间主要为基肥(60%,3月底)、分蘖肥(20%,5月)、穗粒肥(20%,6月),稻田施用的水溶性化肥(尿素、硫酸铵、硝酸钾等)主要随着降雨-农田径流流失[30]。结合研究期间降雨量特征(图 2a),2020年降雨量主要集中在3—7月,因此稻田施用的化肥主要集中在3—7月流失进入水库,并在水库中蓄积,这与2020年3—8月水库TN浓度显著升高特征(图 2a)相一致;至2020年8月采样期间早稻已经收割,水库上游径流携带的NO3--N主要来源于农田土壤氮淋失,且这部分氮负荷相较于氮肥流失较少,因此水库水体NO3--N仍主要来源于农业氮肥流失。以上结果进一步佐证了基于δ15N-NO3-、δ18O-NO3-氮污染溯源分析结果。
4 结论1) 本文研究的赣江水系吉安市某水源水库水华暴发的主要原因为2020年水库TN浓度显著升高(由0.77 mg/L升高至1.57 mg/L),超出了国际公认的水华暴发TN阈值(0.5~1.2 mg/L),加之夏季高温(32℃)、水库蓄水量较低,促进了藻类生长和水华暴发。
2) 水华暴发导致水库表层水TN主要赋存形态由NO3--N转变为有机氮。其中,无水华期TN主要赋存形态为NO3--N(占比>90%);水华暴发期,TN主要赋存形态为有机氮(占比~86%)。水库表层水氮赋存形态转化的主要原因为藻类同化吸收作用,藻类同化作用导致硝酸盐氮、氧同位素富集了6.48 ‰。
3) 硝酸盐氮、氧同位素示踪结果表明,水库NO3--N主要来源于上游稻田流失的氮肥,其负荷贡献率高达64.45%;其次为上游山区土壤氮流失(14.08%);大气沉降和农村生活污水负荷贡献率较低,仅为12.35% 和9.12%。由于NO3--N是水库表层水TN的主要赋存形态,因此水库TN优先控制污染源为上游稻田流失的氮肥。
5 附录附表Ⅰ见电子版(DOI:10.18307/2024.0412)。
| 附表Ⅰ 2020年8月水华暴发期水库及其主要污染源水质与硝酸盐δ15N、δ18O组成 Appendix Ⅰ Water quality, δ15N and δ18O of nitrate in drinking water source reservoir and its main pollution sources during algal bloom in August 2020 |
| [1] |
Qin BQ, Gao G, Zhu GW et al. Lake eutrophication and its ecosystem response. Chinese Science Bulletin, 2013, 58(9): 961-970. [秦伯强, 高光, 朱广伟等. 湖泊富营养化及其生态系统响应. 科学通报, 2013, 58(9): 961-970.] |
| [2] |
Huang JC, Zhang YJ, Arhonditsis GB et al. The magnitude and drivers of harmful algal blooms in China's lakes and reservoirs: A national-scale characterization. Water Research, 2020, 181: 115902. DOI:10.1016/j.watres.2020.115902 |
| [3] |
Xu ZW, Zhang XY, Xie J et al. Total nitrogen concentrations in surface water of typical agro- and forest ecosystems in China, 2004-2009. PLoS One, 2014, 9(3): e92850. DOI:10.1371/journal.pone.0092850 |
| [4] |
Lu WK, Yu LX, Ou XK et al. Relationship between occurrence frequency of cyanobacteria bloom and meteorological factors in Lake Dianchi. J Lake Sci, 2017, 29(3): 534-545. [鲁韦坤, 余凌翔, 欧晓昆等. 滇池蓝藻水华发生频率与气象因子的关系. 湖泊科学, 2017, 29(3): 534-545. DOI:10.18307/2017.0302] |
| [5] |
Cao J, Tian ZB, Chu ZS et al. Nitrogen and phosphorus control thresholds of cyanobacterial blooms in Lake Taihu. J Lake Sci, 2022, 34(4): 1075-1089. [曹晶, 田泽斌, 褚昭升等. 太湖蓝藻水华暴发的氮磷控制阈值分析. 湖泊科学, 2022, 34(4): 1074-1089. DOI:10.18307/2022.0403] |
| [6] |
Zhang M, Shi XL, Yang Z et al. The variation of water quality from 2012 to 2018 in Lake Chaohu and the mitigating strategy on cyanobacterial blooms. J Lake Sci, 2020, 32(1): 11-20. [张民, 史小丽, 阳振等. 2012—2018年巢湖水质变化趋势分析和蓝藻防控建议. 湖泊科学, 2020, 32(1): 11-20. DOI:10.18307/2020.0102] |
| [7] |
Lv XY, Zhu MY, Ma YS et al. Driving factors of algal blooms in drinking-water reservoirs in Lake Taihu Basin. J Lake Sci, 2023, 35(5): 1516-1528. [吕翔宇, 朱梦圆, 马永山等. 太湖流域典型水源水库藻类水华的促发条件. 湖泊科学, 2023, 35(5): 1516-1528. DOI:10.18307/2023.0511] |
| [8] |
Huang TL, Chai BB. Advances in the study of controlling mechanics and technology for source water reservoir quality. Advances in Earth Science, 2009, 24(6): 588-596. [黄廷林, 柴蓓蓓. 水源水库水质污染与富营养化控制技术研究进展. 地球科学进展, 2009, 24(6): 588-596. DOI:10.3321/j.issn:1001-8166.2009.06.003] |
| [9] |
Smith VH, Tilman GD, Nekola JC. Eutrophication: Impacts of excess nutrient inputs on freshwater, marine, and terrestrial ecosystems. Environmental Pollution, 1999, 100: 179-196. DOI:10.1016/S0269-7491(99)00091-3 |
| [10] |
Xu H, Paerl HW, Qin B et al. Determining critical nutrient thresholds needed to control harmful cyanobacterial blooms in eutrophic Lake Taihu, China. Environmental Science & Technology, 2015, 49(2): 1051-1059. DOI:10.1021/es503744q |
| [11] |
Xu H, Paerl HW, Qin BQ et al. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China. Limnology and Oceanography, 2010, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| [12] |
Paerl HW, Otten TG. Harmful cyanobacterial blooms: Causes, consequences, and controls. Microbial Ecology, 2013, 65(4): 995-1010. DOI:10.1007/s00248-012-0159-y |
| [13] |
Chen NW, Mo QL, Kuo YM et al. Hydrochemical controls on reservoir nutrient and phytoplankton dynamics under storms. Science of the Total Environment, 2018, 619/620: 301-310. DOI:10.1016/j.scitotenv.2017.09.216 |
| [14] |
Qin BQ, Zhou J, Elser JJ et al. Water depth underpins the relative roles and fates of nitrogen and phosphorus in lakes. Environmental Science & Technology, 2020, 54(6): 3191-3198. DOI:10.1021/acs.est.9b05858 |
| [15] |
Liu X, Qian KM, Chen YW et al. Spatial and seasonal variation in N2-fixing cyanobacteria in Poyang Lake from 2012 to 2016: Roles of nutrient ratios and hydrology. Aquatic Sciences, 2019, 81(3): 1-12. DOI:10.1007/s00027-019-0639-y |
| [16] |
Kohl DH, Shearer GB, Commoner B. Fertilizer nitrogen: Contribution to nitrate in surface water in a corn belt watershed. Science, 1971, 174(4016): 1331-1334. DOI:10.1126/science.174.4016.1331 |
| [17] |
Xue DM, Botte J, De Baets B et al. Present limitations and future prospects of stable isotope methods for nitrate source identification in surface-and groundwater. Water Research, 2009, 43(5): 1159-1170. DOI:10.1016/j.watres.2008.12.048 |
| [18] |
Nikolenko O, Jurado A, Borges AV et al. Isotopic composition of nitrogen species in groundwater under agricultural areas: A review. Science of the Total Environment, 2018, 621: 1415-1432. DOI:10.1016/j.scitotenv.2017.10.086 |
| [19] |
Kendall C, Elliott EM, Wankel SD. Tracing anthropogenic inputs of nitrogen to ecosystems. In: Michener R, Lajtha K eds, Stable Isotopes in Ecology and Environmental Science: Second Edition. Oxford: Wiley Blackwell, 2008: 375-449.
|
| [20] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [21] |
Wang SY, Wang XM, Jiang YY et al. Abundance and functional importance of complete ammonia oxidizers and other nitrifiers in a riparian ecosystem. Environmental Science & Technology, 2021, 55(8): 4573-4584. DOI:10.1021/acs.est.0c00915 |
| [22] |
McIlvin MR, Casciotti KL. Technical updates to the bacterial method for nitrate isotopic analyses. Analytical Chemistry, 2011, 83(5): 1850-1856. DOI:10.1021/ac1028984 |
| [23] |
Phillips DL, Koch PL. Incorporating concentration dependence in stable isotope mixing models. Oecologia, 2002, 130(1): 114-125. DOI:10.1007/s004420100786 |
| [24] |
Parnell AC, Inger R, Bearhop S et al. Source partitioning using stable isotopes: Coping with too much variation. PLoS One, 2010, 5(3): e9672. DOI:10.1371/journal.pone.0009672 |
| [25] |
Zhu GW, Qin BQ, Zhang YL et al. Variation and driving factors of nutrients and chlorophyll-a concentrations in northern region of Lake Taihu, China, 2005-2017. J Lake Sci, 2018, 30(2): 279-295. [朱广伟, 秦伯强, 张运林等. 2005—2017年北部太湖水体叶绿素a和营养盐变化及影响因素. 湖泊科学, 2018, 30(2): 279-295. DOI:10.18307/2018.0201] |
| [26] |
Shen YS, Huang YY, Hu J et al. The nitrogen reduction in eutrophic water column driven by Microcystis blooms. Journal of Hazardous Materials, 2020, 385: 121578. DOI:10.1016/j.jhazmat.2019.121578 |
| [27] |
Granger J, Sigman DM, Rohde MM et al. N and O isotope effects during nitrate assimilation by unicellular prokaryotic and eukaryotic plankton cultures. Geochimica et Cosmochimica Acta, 2010, 74(3): 1030-1040. DOI:10.1016/j.gca.2009.10.044 |
| [28] |
Granger J, Sigman DM, Needoba JA et al. Coupled nitrogen and oxygen isotope fractionation of nitrate during assimilation by cultures of marine phytoplankton. Limnology and Oceanography, 2004, 49(5): 1763-1773. DOI:10.4319/lo.2004.49.5.1763 |
| [29] |
Fenech C, Rock L, Nolan K et al. The potential for a suite of isotope and chemical markers to differentiate sources of nitrate contamination: A review. Water Research, 2012, 46(7): 2023-2041. DOI:10.1016/j.watres.2012.01.044 |
| [30] |
Wu QL, Ruan XH, Wu CM et al. Analyses of sources and transformation of nitrogen as a contaminant in the river and lake water in the western region of the Taihu Lake Basin. Acta Scientiae Circumstantiae, 2015, 35(12): 3883-3889. [吴庆乐, 阮晓红, 吴朝明等. 太湖西部河湖氮污染物来源及转化途径分析. 环境科学学报, 2015, 35(12): 3883-3889. DOI:10.13671/j.hjkxxb.2015.0135] |
 2024, Vol. 36
2024, Vol. 36 

