(2: 南昌大学鄱阳湖环境与资源利用教育部重点实验室,南昌 330031)
(3: 江西鄱阳湖国家级自然保护区管理局,南昌 330038)
(2: Key Laboratory of Poyang Lake Environment and Resource Utilization, Ministry of Education, Nanchang University, Nanchang 330031, P.R.China)
(3: Jiangxi Poyang Lake National Nature Reserve Authority, Nanchang 330038, P.R.China)
据全球气候变化模型预测,随着人类活动对全球气候的影响日益加剧,干旱、洪水等极端气候事件在未来将更加频繁和强烈[1-2]。洪水长期以来一直是长江中下游浅水湖泊面临的重要生态问题,也是调控湖泊生态系统过程与功能的关键因子[3-4]。极端洪水可以导致浅水湖泊水位在短时间内快速抬升以及入湖营养负荷发生较大的变化[5-6]。水位急剧上升和水体营养负荷量增加对沉水植物功能性状、生长发育状况及整个生态系统均有深远的影响[7-9]。
沉水植物是浅水湖泊中重要的初级生产者,具有降低富营养化水体营养负荷、调节水体溶解氧和透明度、为浮游动物提供避难所以及为鱼类提供觅食、产卵、栖息场所等功能[10]。此外,沉水植物与浮游植物和附着藻类之间存在此消彼长的负相互作用[11-12]。过多的营养物会促进浮游植物的生长,导致水体中光衰减增加,对沉水植物的丰度造成负面影响[13-14]。高浓度营养物还会促进附着藻类的生长,使得到达沉水植物叶片表面的光照进一步减少,最终可能导致沉水植物的消退,水体从清水态向浊水态转变[14-15]。
由于大部分沉水植物的整个植株位于水面以下(开花期除外),水位波动和营养负荷(养分脉冲)均可显著影响沉水植物生长所需的光照条件和物质环境,气候变化导致的极端洪水显然会影响植物的正常生长发育[4,16]。以往关于极端洪水对沉水植物影响的研究大多集中在水位波动[16-17]或脉冲式营养负荷的单独影响[18-19]。一些研究表明,中等强度的水位波动促进了水生植物生长或影响不大,随着水位波动增强(±60 cm)水生植物的生长受到抑制[16,20-22]。Li等[16]发现,水位波动振幅越大,刺苦草(Vallisneria spinulosa)有性繁殖分配越少。Zhang等[18]表明,短期内极端的脉冲式N输入对沉水植物只会造成暂时性的影响。Zhi等[23]的模拟实验研究显示,在低营养的清水系统中,密刺苦草(V. denseserrulata)的生物量对水位上升和营养负荷增加的联合作用响应不明显。然而,富营养化水体中水位波动以及由此引起的NP输入改变如何共同影响水生植物的生长繁殖特性和生物量分配模式,相关研究比较匮乏,尤其缺少实验研究[24]。叶、茎、根和繁殖体作为植物的主要器官,其生物量积累和分配在极端洪水下如何响应以及两种环境胁迫是否存在协同作用并不清晰。
在全球气候变暖的背景下,长江中下游泛滥平原是受洪水干扰比较频繁的区域之一[25],同时也是中国水生植物比较集中的区域[26]。本实验以长江中下游具有代表性的水生植物——苦草(V. natans)为研究对象,基于人工实验水池研究极端洪水对植物生长、有性繁殖和生物量分配的影响以及水体营养状况、浮游植物和附着藻类的变化,旨在探讨极端洪水的两个环境效应——水位抬升与水体营养负荷增加(NP输入)对植物的单独及共同影响。本实验设置了不同的水位上升速度和NP营养盐输入量,模拟4种水位情景:对照(C: 水位保持恒定)、极端洪水处理(E: 水位急剧上升及NP输入)、一般洪水处理(G: 水位逐步上升及NP输入)、恒定水位+营养盐处理(C+N: 水位保持恒定及NP输入),提出以下假设:(1) 水位上升与营养负荷的单独作用均可抑制沉水植物的营养生长,进而影响其有性繁殖能力;(2) 水位上升和营养盐输入负荷增加均可促进藻类(浮游植物和附着藻类)的生长及遮荫效应,从而间接抑制沉水植物的生长; (3) 水位上升与营养负荷对沉水植物的生长具有协同作用,导致沉水植物衰退加剧。
1 材料与方法 1.1 研究地区和实验材料本实验在中国科学院鄱阳湖湖泊湿地观测研究站(29°26′N, 116°03′E)进行。鄱阳湖(28°25′~29°45′N, 115°48′~116°44′E)是中国最大的淡水湖,湖区属于亚热带季风气候,总降雨量为1400~1700 mm,年平均温度16.5~17.8℃。鄱阳湖湖盆内分布102个碟形湖,沉水植物分布于汛期水深1~6 m的水域,苦草是优势物种[27]。苦草呈莲座型生长,多为一年生,以有性繁殖为主(盛花期为8-9月),产生种子后,植株会全部死完[28]。苦草广泛分布于中国和世界各地,具有很强的适应弱光环境的能力,并能定植于贫营养—富营养型淡水水体[29-30]。苦草常作为重建湖泊水生植被的重点先锋物种。因此,苦草长期以来成为研究沉水植物对环境响应的重要材料,也是湖泊水生态修复的优良物种。
1.2 实验设计2019年5月,从采集的苦草中随机取444株大小一致、长势良好的幼苗(5~6枚叶片,株高(16.5±0.1) cm),小心清除植株上的藻类,随后按单株移栽到直径20 cm,深19 cm的塑料桶内(基质为鄱阳湖洲滩底泥和湖沙混合物,体积比=4 ∶1,厚度为17 cm,总氮(TN)、总磷(TP)和有机质含量分别为(2.2±0.07) mg/g、(0.27±0.03) mg/g和6.8 % ±0.06 %,n=3)。本研究采用随机区组设计,设置4种不同水位处理,每个实验处理3个重复。施加处理前将塑料桶随机分配到12个混凝土水池(2 m×2 m,深1.7 m),每个水池有苦草37株,将塑料桶用绳子吊在水池的钢管上,调整至水下75 cm,预培养10 d。水位处理开始前,水体TN、TP和叶绿素a(Chl.a)浓度分别为(1.26±0.12) mg/L、(0.21±0.05) mg/L和(19.2±4.3) μg/L(n=12)。
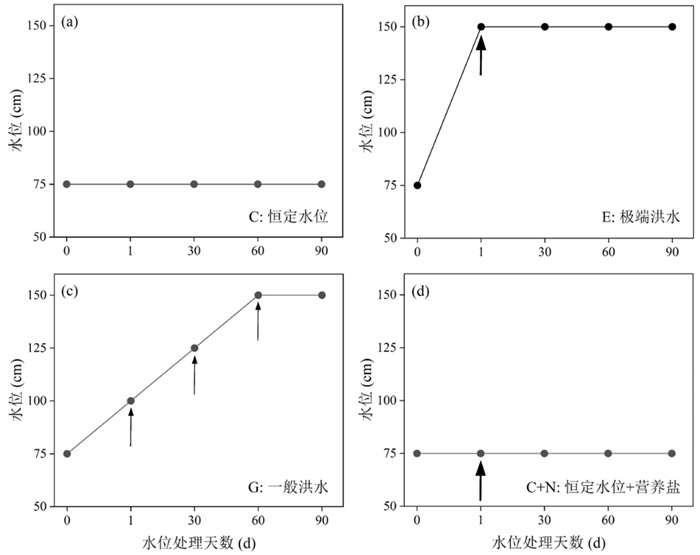
实验周期(90 d)内,设置4个水位处理(附图Ⅰ):对照组(C)、极端洪水处理组(E)、一般洪水处理组(G)、恒定水位+营养盐处理组(C+N)。C组指0次水位波动,水位在75 cm处保持90 d,不施加营养盐;E组指1次水位波动,实验开始时(第1天)水位从75 cm快速增加至150 cm,同时施加1次营养盐;G组指3次水位波动,实验周期90 d内水位分3次从75 cm增加至150 cm,即从75 cm增加至100 cm保持30 d,然后从100 cm增加至125 cm保持30 d,继续从125 cm增加至150 cm保持30 d至实验结束,每次水位增加时施加1次营养盐,一共施加3次;C+N组指在实验周期90 d内,水位保持在75 cm,实验开始时施加1次营养盐,目的是为了辨识极端洪水事件中水位升高与营养负荷增加两个因素的各自影响。实验周期内,E、G和C+N三个水位处理的营养盐输入总量相同(N: 8000 mg/m2,P: 187.5 mg/m2),采用缓慢调整绳子长度的方式人工模拟水位抬升,通过施加KNO3和KH2PO4控制水体NP营养输入。为了采集附着生物,每个水池中挂6块长20 cm,宽4 cm的人工基质板(PVC材质),保持垂直方向,基质板的下边缘与塑料桶上边缘处于同一水深。实验期间定期加水,进行日常维护。每7 d监测1次各处理的水下光照情况,每次于中午12:00-13:00利用Li-1400数据记录器和Li COR UWQ-192SA传感器测定不同水深(0、75、100、125、150 cm)光合有效辐射,分别为(2420±14)、(473±112)、(329±113)、(211±79)、(82±25) μmol/(m2·s)(P < 0.001),不同处理组(C、C+N、E、G)的水下光衰减系数分别为(0.027±0.01)、(0.040±0.01)、(0.043±0.01)、(0.054±0.02) m-1(P < 0.05)。实验期间水温为23.5~32.6℃。
1.3 数据采集自水位波动处理开始之日起的第15、30、45、60、75和90天进行水和附着藻类的采样。水体理化指标包括水温、TN、TP和Chl.a。测定两种附着藻类,第1种是人工基质上的附着藻类,定义为周丛藻类[31],第2种是着生于沉水植物表面的附着藻类,定义为附植藻类[31],以单位面积的Chl.a含量(μg/cm2)表示两者的生物量。每次采样时取550 mL水样用来测定水体TN、TP和浮游植物Chl.a含量(单位水体内浮游植物生物量),采用过硫酸钾氧化法测定TN和TP含量[32],热乙醇法测定Chl.a含量[33]。附植藻类每次采样时于每个水池中随机取1株苦草,剪下第二长叶片,装入塑料密封袋,放在4℃冷藏室内保存,沉水植物样品采集时需要尽可能减少对附着藻类的干扰。每次向密封袋中加入约80 mL蒸馏水,震荡1 min,重复洗脱附着藻类3次以去除植物表面附植藻类,收集的悬浮液经Whatman GF/F滤膜过滤,然后将滤膜向内对折,装入塑料密封袋-20℃低温保存24 h后用热乙醇法萃取测定Chl.a。周丛藻类每次采样时于每个水池中选取1块基质板,用约250 mL自来水清洗,保证全部清除附着物质,最终采用热乙醇法萃取测定Chl.a。
第90天时收获植物材料。为避免池壁造成的阴影对实验产生影响,从每个中宇宙选取不靠近池壁的雌株12株,洗净后检测如下指标:株高、比叶面积、分株数、叶片数、间隔子数、间隔子总长、最大根长以及花果数(雌花数和果实数之和)。随后,将每个植株分成叶片、地下器官(包括间隔子和根系)及有性繁殖器官(包括雌花和果实),在75℃烘箱中烘干至恒重,用电子天平称量每一部分的干重,相加后得到一个植株的总生物量。繁殖器官花和果实的干重之和为有性繁殖生物量。各器官生物量分配比是植物各器官与植物总生物量之比。比叶面积是通过植物叶面积(用AM-350叶面积仪测定)除以叶生物量得出。测定指标共计17个。
1.4 数据分析采用SPSS 19.0进行统计分析。应用双因素方差分析(Two-way ANOVA)评估不同水位处理(对照、极端洪水、一般洪水、恒定水位+营养盐处理)和区组对植物个体生长、形态、繁殖参数以及各个器官生物量分配比的影响,应用重复测量方差分析(RM-ANOVA)评估水位处理和取样时间对水质参数(TN、TP和Chl.a)、周丛藻类和附植藻类生物量的影响,分析前均进行正态性和方差齐性检验,若数据方差不齐或不满足正态分布,将其进行log10转换后再进行方差分析。若不同处理间存在显著性差异,进一步应用Tukey检验作为后验检验进行多重比较,显著性水平为0.05。
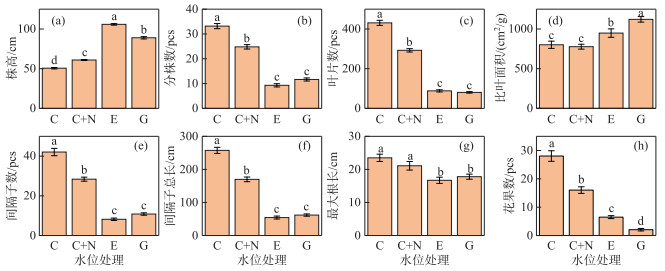
2 结果与分析 2.1 沉水植物形态、繁殖特征和生物量不同水位处理显著地影响苦草的外部形态和有性繁殖(表 1)。苦草的株高在E处理下((105.9± 0.96) cm)显著大于G、C+N和C处理组,而在C处理组下的株高最小((50.6±0.89) cm)(图 1a)。分株数、叶片数、间隔子数和间隔子总长对不同水位处理的响应相似,苦草的分株数、叶片数、间隔子数和间隔子总长在E和G处理组下显著降低,而在C处理组下4个形态指标最大(图 1b,c,e,f)。苦草的比叶面积在G处理组下最大,其次为E处理组,而C和C+N处理组间无明显差异(图 1d)。苦草的最大根长在E和G处理组中都显著小于C和C+N处理组,而后二者间无明显差异(图 1g)。E、G和C+N处理组均显著降低了苦草的花果数,而且E和G处理组下的花果数都显著低于C+N处理组(图 1h)。
| 表 1 不同水位处理和区组关于苦草生长繁殖特征和生物量分配的二元方差分析结果 Tab. 1 Two-way ANOVA results for different water level treatments and block on growth, reproductive characteristics and biomass allocation of V. natans |
|
图 1 苦草形态特征和有性繁殖在4种水位处理下的多重比较结果 (不同字母代表组间差异显著(P < 0.05), 下同) Fig.1 Results of multiple comparisons for morphological characteristics and sexual reproduction in V. natans among four water level treatments (Values with different letters indicate significant differences among water level treatments (P < 0.05), the sames below) |
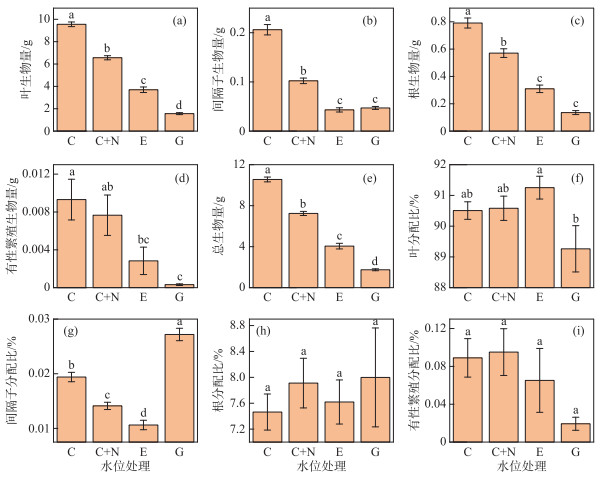
苦草的地上和地下部分生物量明显受不同水位处理的影响(表 1)。叶生物量和总生物量响应于不同水位处理变化趋势相似,均为G < E < C+N < C组(图 2a,e)。间隔子生物量和根生物量对不同水位处理的响应相似,苦草的间隔子生物量和根生物量均为在C处理组最大,其次为C+N处理组,而在E和G两个处理组间无显著差异(图 2b,c)。苦草的有性繁殖生物量在E和G处理组下都显著小于C处理组,而C+N和C两个处理组间无显著差异(图 2d)。
|
图 2 苦草生物量和生物量分配在4种水位处理下的多重比较结果 Fig.2 Results of multiple comparisons for biomass and biomass allocation to organs in V. natans among four water level treatments |
虽然双因素方差分析结果表明,不同水位处理显著影响叶生物量分配比例(表 1),但E和C、C+N处理组之间以及G和C、C+N处理组之间无显著差异(图 2f)。苦草的叶分配比在E处理组下显著大于G处理组(图 2f)。相比于C和C+N处理组,E处理组显著降低了生物量对间隔子的分配,而G处理组显著增加了生物量对间隔子的分配(图 2g)。苦草的根生物量分配比例在各处理组间无显著变化(图 2h)。在所有水位处理下苦草的有性繁殖分配比例都相对较低(< 0.1 %)(图 2i)。
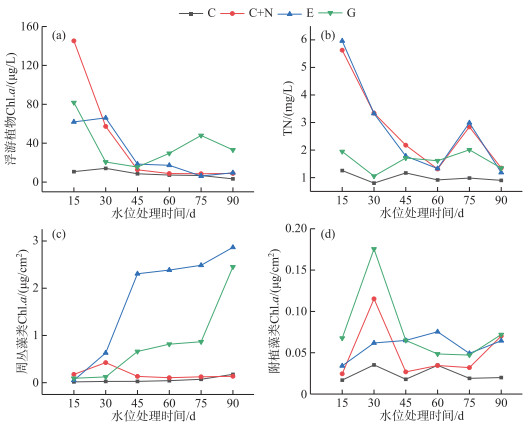
2.3 水体营养和叶绿素a浓度水位处理开始前,水体Chl.a、TN和TP浓度无显著差异(P>0.05)。实验期间4个水位处理组间TP浓度无显著差异(表 2, P>0.05)。水体Chl.a在C处理组中浓度最低(图 3a),平均值为(8.3±1.8) μg/L,相比之下,E、G和C+N三组处理组间水体Chl.a无显著差异,分别为(28.5±8.6)、(35.9±7.6)和(37.6±17.5) μg/L。4个水位处理组间水体TN浓度存在显著差异(表 2, P < 0.05),其中C处理组的水体TN浓度显著低于G、E和C+N处理组(图 3b,表 2),水体TN浓度从小到大依次是C处理组(1.02±0.05) mg/L、G处理组(1.59±0.12) mg/L、E处理组(2.61±0.48) mg/L和C+N处理组(2.63±0.44) mg/L。
|
图 3 实验周期90 d内4种水位情景下浮游植物、周丛藻类、附植藻类生物量和TN浓度的动态变化 Fig.3 Changes of phytoplankton, periphyton and epiphyton biomass and TN concentration during the 90-day experimental period in four water level scenarios |
实验期间周丛藻类生物量在E、G处理组中随时间呈增长趋势,而在C、C+N处理组中保持相对稳定(图 3c)。不同水位处理组对周丛藻类生物量(Chl.a)有显著影响(表 2, P < 0.05)。多重比较结果表明,周丛藻类生物量在E处理组中最大,平均值为(1.79±0.27) μg/cm2,其次为G处理组(0.83±0.20) μg/cm2,相比之下,C+N和C处理组的周丛藻类生物量最小,分别为(0.18±0.03)和(0.06±0.01) μg/cm2。附植藻类生物量(Chl.a)随时间显著变化(图 3d,表 2),但平均值相对较低(< 0.1 μg/cm2)。总体而言,G处理组的附植藻类生物量(0.08±0.01) μg/cm2最大,而且E((0.06±0.006) μg/cm2)、C+N处理组((0.05±0.01) μg/cm2)的附植藻类生物量显著高于C处理组((0.02±0.004) μg/cm2)(图 3d,表 2)。
| 表 2 不同水位处理和取样时间关于水质参数、周丛藻类和附植藻类生物量的两因素重复测量方差分析结果 Tab. 2 Two-way repeated measures ANOVA results for different water level treatments and sampling time on water properties and biomass of periphyton and epiphyton |
在全球气候变化背景下,极端洪水事件的增加将改变水位和水质,从而影响湖泊生态系统[34]。长期来看,水位波动增加会导致水生植物覆盖率和多样性下降[4,35]。本研究实验周期90 d内所有植株都得以存活,这表明苦草对两种水位增加处理(急剧/逐步上升)均有一定的适应性。水位升高时光资源减少,苦草由倾向于横向生长(与营养繁殖有关)逐渐转变为倾向于垂向生长(与株高有关)[36]。水位波动增加时,沉水植物通过增加株高和比叶面积以适应深水位时低光照胁迫[16]。这些研究结果与本实验的结果相似。而Han等[37]表明水深大于3 m将会严重降低沉水植物苦草的存活率。在本实验中,相对于C+N处理组,两个水位增加处理组(E组和G组)实际上在一定时间内增加了苦草淹水的程度,导致植株的一系列形态和生物量指标(如间隔子数、间隔子总长、最大根长、花果数、叶生物量、间隔子生物量、根生物量、有性繁殖生物量和总生物量)明显降低,这说明极端的水位变化和逐步的水位变化均可能抑制植株地上部分营养生长、产生无性克隆分株和根系营养吸收能力,导致生物量积累放缓,不利植物繁殖(营养繁殖和有性繁殖)。同样,Li等[38]表明随着水深从100 cm增加至150 cm,苦草有性繁殖明显受到抑制,这可能与胁迫环境(深水位)下传粉、受精及种子的形成易受阻有关。在本实验中,相对于C+N处理组,两个水位增加处理组(G和E)中的周丛藻类生物量均显著增加,可见周丛藻类生物量与沉水植物生物量呈负相关。通常,水位增加加剧底泥的厌氧条件,厌氧条件会促进微生物的生长,促进底质营养(如P)释放[39],营养物的增加可能反过来促进周丛藻类的生长。两个水位增加处理组(G和E)中的周丛藻类生物量分别为附植藻类生物量的10倍和30倍,这可能是沉水植物对其叶片表面附植藻类的化感抑制作用造成的[40]。相比于一般洪水处理,极端洪水处理下苦草的叶生物量分配明显增加,而间隔子生物量分配明显降低,这说明随水位上升速度增加,植株地上部分生物量分配增加以获取更多光照。
3.2 营养负荷增加对沉水植物的影响极端洪水导致的径流增加可能导致湖泊水体中NP营养负荷增加并引起富营养化[41]。在一定范围内水体营养增加,有利于沉水植物的生长,但当水体营养浓度超过临界阈值,可以通过促进浮游植物或附着藻类的生长,间接地负向作用于沉水植物的生长。在本实验中,相对于对照组(C),C+N处理组显著降低了苦草的总生物量、叶生物量、间隔子生物量、根生物量、分株数、叶片数、间隔子数、总间隔子长和间隔子生物量分配,说明营养负荷增加对沉水植物的正常生长发育和营养繁殖造成了显著负面影响。虽然E、G和C+N处理组中的附植藻类生物量均显著高于C处理组,但是本实验的所有中宇宙中附植藻类生物量均较低(Chl.a < 1 mg/m2),因此附植藻类单独对沉水植物产生的遮光作用较小[42]。同样,本研究显示E、G和C+N处理组中的浮游植物Chl.a浓度均显著大于C处理组。相比于一些以刺苦草[18]和密刺苦草[23]为对象并且中宇宙类型相同的研究,本实验中E、G和C+N处理组的浮游植物Chl.a浓度(28.5~37.6 μg/L)与之相近或更高。Wang等[43]表明长江中下游浅水湖泊中沉水植物衰退时水体Chl.a浓度一般在10 μg/L以上。藻类大量生长引起的水下光照弱化被认为是富营养湖泊中沉水植物衰退的重要原因之一。因此,本实验体系中营养负荷对苦草生长的负向影响较大,可能是由于浮游植物对苦草的遮光抑制造成的。除了遮光抑制外,浮游植物对光能、溶解无机碳的强烈竞争也会抑制苦草的光合作用[44]。相比于C处理组,G、E和C+N处理组中TN浓度均显著提高,可以促进浮游藻类的生长,进而抑制了苦草的生长,这与Yu等[45]关于N负荷梯度负向影响苦草生长的原位实验研究结果相似。但相较之下,一些研究表明N负荷升高会促进附着藻类生长[46],进而抑制水生植物生长[14,47]。此外,本研究还发现营养盐输入负荷增加虽然导致苦草有性繁殖器官数量显著降低,但是对苦草有性繁殖器官生物量及其分配无显著影响,说明保持有性繁殖可能是苦草在较高营养水平下维持种群遗传多样性的一种手段。这与Wan等[48]关于不同营养化水平湖泊水生植物繁殖策略的比较研究中穿叶眼子菜(Potamogeton perfoliatus)的表现相似。
3.3 水位抬升和营养负荷增加对沉水植物的复合影响本研究发现,水位抬升和营养负荷的联合作用(C与G或E比较)显著降低了苦草地上部分营养生长、根系生长以及有性繁殖能力。从二者联合作用的模式来看,水位抬升和营养负荷增加对苦草的生长是协同作用,即水位上升和营养负荷的联合作用会使入湖营养负荷加强水位上升对沉水植物生长和有性繁殖的影响效应。水深是影响光可利用性的重要因子,而后者对沉水植物与其他初级生产者之间竞争结果发挥重要作用。水位急剧上升时,随着营养负荷增加,大量生长的浮游植物可以进一步影响到水柱中光照以及到达沉水植物叶片表面的光照。许多研究都表明,良好的光照条件与水生植物生长发育状况和丰度密切相关[29,49-50]。因此可以认为极端洪水对沉水植物的不利影响较大,随着气候变化导致世界大部分地区极端洪水事件增多和加剧,预计会增加湖泊由“草型清水态”向“藻型浊水态”转变的风险。未来的湖泊管理要充分考虑水体富营养化、气候变化和水文因素对沉水植物的影响。
4 结论1) 极端洪水包括水位抬升和由此引起的NP输入改变双重效应。水位急剧变化和逐步变化均抑制了苦草地上部分营养生长、根系生长和有性繁殖,促进了周丛藻类的生长。水位急剧上升时,植株对间隔子的生物量投资倾向于最小,而株高和植株对叶的生物量投资倾向于最大以获取更多光照。
2) 在本研究营养浓度较高的实验体系中,脉冲式营养输入增加了水体N浓度,促进了浮游植物生长,并可能通过浮游植物的遮荫效应抑制沉水植物地上(叶)和地下部分(根和间隔子)生长。
3) 水位上升和营养负荷两个环境因素的联合作用会使入湖营养负荷加强水位上升对沉水植物生长和有性繁殖的影响效应,不利于沉水植物生长发育。
5 附录附图Ⅰ见电子版(DOI: 10.18307/2024.0442)。
|
附图Ⅰ 水位处理示意图:(a)对照(C:恒定水位),(b)极端洪水处理(E:水位急剧上升,营养盐输入1次),(c)一般洪水处理(G:水位逐步上升,营养盐输入3次),(d)恒定水位+营养盐处理(C+N:恒定水位,营养盐输入1次),实验周期90 d内E、G、C+N三个水位处理营养盐的总输入量相同。黑色箭头表示该时间施加营养盐,箭头越粗表示营养盐输入量越大 AttachedFig1 Schematic diagram of water level treatments: (a) Control (C: constant water level), (b) extreme flood treatment (E: sudden water level increase with one pulse of nutrient input), (c) normal flood treatment (G: gradual water level increase with three pulses of nutrient input) (d) constant water level and nutrient treatment (C+N: constant water level with one pulse of nutrient input). The amounts of nutrient input over the 90-day period of the experiment were the same among E, G and C+N. A black arrow indicates one pulse of nutrient input at relative time point and the thicker arrow indicates higher nutrient input into the water column |
| [1] |
Pörtner HO, Roberts DC, Tignor M et al. IPCC 2022: Climate change 2022: Impacts, adaptation and vulnerability. Contribution of working group Ⅱ to the sixth assessment report of the Intergovernmental Panel on Climate Change. New York: Cambridge University Press, 2022. DOI:10.1017/9781009325844
|
| [2] |
Jeppesen E, Pierson D, Jennings E. Effect of extreme climate events on lake ecosystems. Water, 2021, 13(3): 282. DOI:10.3390/w13030282 |
| [3] |
Li W, Liu GH, Xiong BH et al. The restoration of aquatic vegetation in lakes of Poyang Lake Nature Reserve after catastrophic flooding in 1998. Journal of Wuhan Botanical Research, 2004, 22(4): 301-306. [李伟, 刘贵华, 熊秉红等. 1998年特大洪水后鄱阳湖自然保护区主要湖泊水生植被的恢复. 武汉植物学研究, 2004, 22(4): 301-306.] |
| [4] |
Wang LG, Han YQ, Yu HH et al. Submerged vegetation and water quality degeneration from serious flooding in Liangzi Lake, China. Frontiers in Plant Science, 2019, 10: 1504. DOI:10.3389/fpls.2019.01504 |
| [5] |
Coops H, Beklioglu M, Crisman TL. The role of water-level fluctuations in shallow lake ecosystems-workshop conclusions. Hydrobiologia, 2003, 506(1): 23-27. DOI:10.1023/B:HYDR.0000008595.14393.77 |
| [6] |
Jeppesen E, Kronvang B, Meerhoff M et al. Climate change effects on runoff, catchment phosphorus loading and lake ecological state, and potential adaptations. Journal of Environmental Quality, 2009, 38(5): 1930-1941. DOI:10.2134/jeq2008.0113 |
| [7] |
Leigh C, Bush A, Harrison ET et al. Ecological effects of extreme climatic events on riverine ecosystems: Insights from Australia. Freshwater Biology, 2015, 60(12): 2620-2638. DOI:10.1111/fwb.12515 |
| [8] |
Winemiller KO, Montaña CG, Roelke DL et al. Pulsing hydrology determines top-down control of basal resources in a tropical river-floodplain ecosystem. Ecological Monographs, 2014, 84(4): 621-635. DOI:10.1890/13-1822.1 |
| [9] |
Zhu JG, Deng JC, Zhang YH et al. Response of submerged aquatic vegetation to water depth in a large shallow lake after an extreme rainfall event. Water, 2019, 11(11): 2412. DOI:10.3390/w11112412 |
| [10] |
Jeppesen E, Sondergaard M, Sondergaard M et al. The structuring role of submerged macrophytes in lakes. New York: Springer, 1998. DOI:10.1007/978-1-4612-0695-8
|
| [11] |
Scheffer M, Jeppesen E. Regime shifts in shallow lakes. Ecosystems, 2007, 10(1): 1-3. DOI:10.1007/s10021-006-9002-y |
| [12] |
Blindow I, Hargeby A, Hilt S. Facilitation of clear-water conditions in shallow lakes by macrophytes: Differences between charophyte and angiosperm dominance. Hydrobiologia, 2014, 737(1): 99-110. DOI:10.1007/s10750-013-1687-2 |
| [13] |
Riis T, Vestergaard O, Larsen SE. Macrophyte decline in Danish lakes and streams over past 100 years. Journal of Ecology, 2000, 88(6): 1030-1040. DOI:10.1046/j.1365-2745.2000.00519.x |
| [14] |
Olsen S, Chan FY, Li W et al. Strong impact of nitrogen loading on submerged macrophytes and algae: A long-term mesocosm experiment in a shallow Chinese lake. Freshwater Biology, 2015, 60(8): 1525-1536. DOI:10.1111/fwb.12585 |
| [15] |
Phillips G, Willby N, Moss B. Submerged macrophyte decline in shallow lakes: What have we learnt in the last forty years?. Aquatic Botany, 2016, 135: 37-45. DOI:10.1016/j.aquabot.2016.04.004 |
| [16] |
Li L, Ding MM, Jeppesen E. Variation in growth, reproduction, and resource allocation in anaquatic plant, Vallisneria spinulosa: The influence of amplitude and frequency of water level fluctuations. Aquatic Sciences, 2020, 82(4): 81. DOI:10.1007/s00027-020-00754-8 |
| [17] |
Wang MZ, Liu ZY, Luo FL et al. Do amplitudes of water level fluctuations affect the growth and community structure of submerged macrophytes?. PLoS One, 2016, 11(1): e0146528. DOI:10.1371/journal.pone.0146528 |
| [18] |
Zhang Z, Cao Y, Jeppesen E et al. The response of Vallisneria spinulosa (Hydrocharitaceae) and plankton to pulse addition of inorganic nitrogen with different loading patterns. Hydrobiologia, 2016, 767(1): 175-184. DOI:10.1007/s10750-015-2494-8 |
| [19] |
Olsen S, Cao Y, Florencia Gutierrez M et al. Effect of a nitrogen pulse on ecosystem N processing at different temperatures: A mesocosm experiment with 15NO3- addition. Freshwater Biology, 2017, 62(7): 1232-1243. DOI:10.1111/fwb.12940 |
| [20] |
Deegan BM, White SD, Ganf GG. The influence of water level fluctuations on the growth of four emergent macrophyte species. Aquatic Botany, 2007, 86(4): 309-315. DOI:10.1016/j.aquabot.2006.11.006 |
| [21] |
Zhang XK, Liu XQ, Ding QZ. Morphological responses to water-level fluctuations of two submerged macrophytes, Myriophyllum spicatum and Hydrilla verticillata. Journal of Plant Ecology, 2013, 6(1): 64-70. DOI:10.1093/jpe/rts009 |
| [22] |
Zhang XL, Ma DY, Pulzatto MM et al. Moderate hydrological disturbance and high nutrient substrate enhance the performance of Myriophyllum aquaticum. Hydrobiologia, 2021, 848(9): 2331-2343. DOI:10.1007/s10750-020-04397-6 |
| [23] |
Zhi YW, Cao Y, Sun JY et al. Indirect effects of extreme precipitation on the growth of Vallisneria denseserrulata Makino. Environmental and Experimental Botany, 2018, 153: 229-235. DOI:10.1016/j.envexpbot.2018.06.003 |
| [24] |
Cao Y, Zhi YW, Jeppesen E et al. Species-specific responses of submerged macrophytes to simulated extreme precipitation: A mesocosm study. Water, 2019, 11(6): 1160. DOI:10.3390/w11061160 |
| [25] |
张晓可. 长江泛滥平原湖泊植物水位波动需求研究[学位论文]. 北京: 中国科学院大学, 2013.
|
| [26] |
Wu ZG, Xiong W, Hou HW. Biodiversity pattern and conservation of aquatic vascular plants in the Yangtze River basin, China. Acta Hydrobiologica Sinica, 2019, 43(S1): 27-41. [吴志刚, 熊文, 侯宏伟. 长江流域水生植物多样性格局与保护. 水生生物学报, 2019, 43(S1): 27-41. DOI:10.7541/2019.164] |
| [27] |
Hu ZP, Lin YR. Analysis of evolution process and driving factors for aquatic vegetations of Poyang Lake in 30 years. Resources and Environment in the Yangtze Basin, 2019, 28(8): 1947-1955. [胡振鹏, 林玉茹. 鄱阳湖水生植被30年演变及其驱动因素分析. 长江流域资源与环境, 2019, 28(8): 1947-1955. DOI:10.11870/cjlyzyyhj201908018] |
| [28] |
Zhou Y, Li XJ, Zhao Y et al. Divergences in reproductive strategy explain the distribution ranges of Vallisneria species in China. Aquatic Botany, 2016, 132: 41-48. DOI:10.1016/j.aquabot.2016.04.005 |
| [29] |
Chen JF, Cao T, Zhang XL et al. Differential photosynthetic and morphological adaptations to low light affect depth distribution of two submersed macrophytes in lakes. Scientific Reports, 2016, 6: 34028. DOI:10.1038/srep34028 |
| [30] |
Yuan GX, Fu H, Zhong JY et al. Growth and C/N metabolism of three submersed macrophytes in response to water depths. Environmental and Experimental Botany, 2016, 122: 94-99. DOI:10.1016/j.envexpbot.2015.09.009 |
| [31] |
Wang QL, Zhi YW, Jiang HS et al. Effects of different initial snail densities on submersed macrophyte Vallisneria spinulosa Yan and its epiphyton. Plant Science Journal, 2017, 35(5): 741-749. [王秋林, 支永威, 江红生等. 不同初始螺类密度对沉水植物刺苦草Vallisneria spinulosa Yan及其附着藻类的影响. 植物科学学报, 2017, 35(5): 741-749. DOI:10.11913/PSJ.2095-0837.2017.50741] |
| [32] |
国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社, 2002.
|
| [33] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method. J Lake Sci, 2006, 18(5): 550-552. [陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨. 湖泊科学, 2006, 18(5): 550-552. DOI:10.18307/2006.0519] |
| [34] |
Woolway RI, Kraemer BM, Lenters JD et al. Global lake responses to climate change. Nature Reviews Earth & Environment, 2020(1): 388-403. DOI:10.1038/s43017-020-0067-5 |
| [35] |
O'Farrell I, Izaguirre I, Chaparro G et al. Water level as the main driver of the alternation between a free-floating plant and a phytoplankton dominated state: A long-term study in a floodplain lake. Aquatic Sciences, 2011, 73: 275-287. DOI:10.1007/s00027-010-0175-2 |
| [36] |
Fu H, Yuan GX, Cao T et al. Clonal growth and foraging behavior of a submerged macrophyte Vallisneria natans in response to water depth gradient. J Lake Sci, 2012, 24(5): 705-711. [符辉, 袁桂香, 曹特等. 水深梯度对苦草(Vallisneria natans)克隆生长与觅食行为的影响. 湖泊科学, 2012, 24(5): 705-711. DOI:10.18307/2012.0510] |
| [37] |
Han YQ, Wang LG, You WH et al. Flooding interacting with clonal fragmentation affects the survival and growth of a key floodplain submerged macrophyte. Hydrobiologia, 2018, 806(1): 67-75. DOI:10.1007/s10750-017-3356-3 |
| [38] |
Li L, Bonser SP, Lan ZC et al. Water depth affects reproductive allocation and reproductive allometry in the submerged macrophyte Vallisneria natans. Scientific Reports, 2017, 7: 16842. DOI:10.1038/s41598-017-16719-1 |
| [39] |
Gächter R, Meyer JS. The role of microorganisms in mobilization and fixation of phosphorus in sediments. Hydrobiologia, 1993, 253(1): 103-121. DOI:10.1007/BF00050731 |
| [40] |
Gao YN, Liu BY, Wang J et al. Allelopathic effects of phenolic compounds released by Vallisneria spiralis on Microcystis aeruginosa. J Lake Sci, 2011, 23(5): 761-766. [高云霓, 刘碧云, 王静等. 苦草(Vallisneria spiralis)释放的酚酸类物质对铜绿微囊藻(Microcystis aeruginosa)的化感作用. 湖泊科学, 2011, 23(5): 761-766. DOI:10.18307/2011.0514] |
| [41] |
Jeppesen E, Kronvang B, Olesen JE et al. Climate change effects on nitrogen loading from cultivated catchments in Europe: Implications for nitrogen retention, ecological state of lakes and adaptation. Hydrobiologia, 2011, 663(1): 1-21. DOI:10.1007/s10750-010-0547-6 |
| [42] |
Roberts E, Kroker J, Körner S et al. The role of periphyton during the re-colonization of a shallow lake with submerged macrophytes. Hydrobiologia, 2003, 506(1): 525-530. DOI:10.1023/B:HYDR.0000008560.73832.1c |
| [43] |
Wang HJ, Wang HZ, Liang XM et al. Total phosphorus thresholds for regime shifts are nearly equal in subtropical and temperate shallow lakes with moderate depths and areas. Freshwater Biology, 2014, 59(8): 1659-1671. DOI:10.1111/fwb.12372 |
| [44] |
黎慧娟. 富营养水体中光照、营养及浮游植物对沉水植物生长和生理影响的研究[学位论文]. 武汉: 中国科学院水生生物研究所, 2006.
|
| [45] |
Yu Q, Wang HJ, Wang HZ et al. Does the responses of Vallisneria natans (Lour.) Hara to high nitrogen loading differ between the summer high-growth season and the low-growth season?. Science of the Total Environment, 2017, 601/602: 1513-1521. DOI:10.1016/j.scitotenv.2017.05.268 |
| [46] |
Tan BC, Li KY, An M et al. Effects of increasing nitrogen loading on the interactions among Bellamya aeruginosa, periphytic algae and Vallisneria spiralis. Acta Scientiae Circumstantiae, 2015, 35(11): 297-302. [谈冰畅, 李宽意, 安苗等. 氮负荷升高对螺-附着藻-苦草生态关系的影响. 环境科学学报, 2015, 35(11): 297-302. DOI:10.13671/j.kjkxxb.2015.0069] |
| [47] |
Zhao ST, Yin LY, Chang FY et al. Response of Vallisneria spinulosa (Hydrocharitaceae) to contrasting nitrogen loadings in controlled lake mesocosms. Hydrobiologia, 2016, 766(1): 215-223. DOI:10.1007/s10750-015-2456-1 |
| [48] |
Wan T, Han QX, Xian L et al. Reproductive allocation in three macrophyte species from different lakes with variable eutrophic conditions. PLoS One, 2016, 11(11): e0165234. DOI:10.1371/journal.pone.0165234 |
| [49] |
Li L, Lan ZC, Chen JK et al. Allocation to clonal and sexual reproduction and its plasticity in Vallisneria spinulosa along a water-depth gradient. Ecosphere, 2018, 9(1): e02070. DOI:10.1002/ecs2.2070 |
| [50] |
Ersoy Z, Scharfenberger U, Baho DL et al. Impact of nutrients and water level changes on submerged macrophytes along a temperature gradient: A pan-European mesocosm experiment. Global Change Biology, 2020, 26(12): 6831-6851. DOI:10.1111/gcb.15338 |
 2024, Vol. 36
2024, Vol. 36 

