摘要
以蓝藻越冬的群落变化特征为基础,为揭示不同湖泊水生态变化,于2022年1月和7月在岱海、乌梁素海和南海湖共选取10个采样点采集上层水与底泥样品,开展了内蒙湖区不同类型湖泊冰封与非冰封时期蓝藻群落结构、丰度变化和多样性的研究。结果表明:蓝藻经历了湖泊冰封期与非冰封期,丰度和多样性都发生了较大变化,可以很好地解释湖泊水生态变化情况,乌梁素海和南海湖非冰封期蓝藻丰度显著高于冰封期,而岱海因其湖泊水质的特殊性,冰封期水体蓝藻丰度显著高于非冰封期水体,而非冰封期底泥蓝藻丰度显著高于冰封期。不同时期不同湖泊蓝藻优势属的生态位宽度不尽相同,非冰封期和冰封期岱海和南海湖优势蓝藻普遍可利用多种资源,而乌梁素海优势蓝藻实际可利用资源较少。根据中性模型和冗余分析可知,非冰封期的乌梁素海和南海湖水体和底泥更多地受到随机过程的影响,相比之下,岱海底泥和南海湖水体则更多地受环境因素的制约;寒区湖泊蓝藻群落的组成、结构及影响因素存在季节差异,水温、总氮、氨氮和pH起到了关键作用。研究结果可为寒区湖泊水生态保护治理提供参考。
Abstract
Based on the community change of overwintering cyanobacteria, this study aimed to elucidate ecological changes in different lakes. A sampling program was conducted at 10 sampling sites in Lake Daihai, Lake Wuliangsuhai, and Lake Nanhai in January and July 2022, with samples from the upper water and sediment. These samples were used to investigate the community structure, abundance variations, and diversity of cyanobacteria in various types of lakes in the Inner Mongolia lake region during both the ice-covered and non-ice-covered periods. The results showed large variation in the abundance and diversity of cyanobacteria between the ice-covered and non-ice-covered periods of lakes, providing a good explanation for the ecological changes. During the non-ice-covered period, the abundance of cyanobacteria in Lake Wuliangsuhai and Lake Nanhai was significantly higher than that during the ice-covered period. Conversely, in Lake Daihai, the abundance of cyanobacteria in water was significantly higher during the ice-covered period than that during the non-ice-covered period, attributed to the unique water quality of the lake, and the abundance of cyanobacteria in the sediment during the non-ice-covered period was significantly higher than that during the ice-covered period. Additionally, the ecological niche widths of the dominant genera in different lakes varied across periods. Specifically, the dominant cyanobacteria in Lake Daihai and Lake Nanhai were generally able to utilize a diverse range of resources during both the non-ice-covered and ice-covered periods, whereas the dominant cyanobacteria in Lake Wuliangsuhai had fewer resources readily available to them. Based on neutral modeling and redundancy analysis, it is clear that during the non-ice-covered period, the water bodies and sediments of Lake Wuliangsuhai and Lake Nanhai were significantly influenced by stochastic processes. In contrast, the sediments of Lake Daihai and the water of Lake Nanhai were more constrained by environmental factors. Additionally, there were seasonal variations in the composition and structure of cyanobacterial communities in cold-region lakes, with the main driving factors of water temperature, total nitrogen, ammonia nitrogen and pH. This study can serve as a valuable reference for the protection and management of lake ecology in cold regions.
Keywords
湖泊作为重要的生态系统,对于人类生活和生态平衡具有不可替代的作用。蓝藻作为一类常见的浮游植物,其在水体生态系统中的作用备受关注。随着人类对湖泊资源的需求不断增加,蓝藻的群落特征及不同时期的动态变化成为当前研究的热点之一。湖泊的富营养化易引发蓝藻的过度繁殖,形成水华,给水生态系统带来了严重挑战。
孔繁翔等提出了蓝藻水华形成的四阶段理论,包括越冬休眠、春季复苏、生长和集聚上浮[1]。在此之前有学者对后宫湖、太湖、巢湖、东湖等进行了大量蓝藻越冬的研究。温度的变化使得湖泊中微囊藻等具有越冬属性蓝藻的生存策略和行为模式发生季节性变化[2]。具有越冬属性的蓝藻在夏季大多位于水体之中生活繁殖,而在进入冬季后大量蓝藻会逐步下沉到湖泊的底泥之中进行越冬,直至来年温度上升,越冬蓝藻小部分会在底泥中死亡分解,大部分从底泥中“苏醒”,上浮到湖泊水体中继续生活繁殖[3]。这些蓝藻通过竞争光、营养和空间资源,逐渐成为水体中的优势类群,在适当情况下上浮的蓝藻可能形成水华[4-5],进而对湖泊生态平衡产生一系列负面影响。蓝藻的大量繁殖导致水体中溶解氧减少,影响其他水生生物的生存,蓝藻还可能释放藻毒素[6],对水体生物和人类健康构成潜在威胁。此外,水华可改变湖泊的透明度、pH值等水质指标[7],进一步削弱湖泊生态系统的稳定性和自净能力。
目前,较多学者已开展了有关蓝藻在湖泊生态系统中作用的研究并考虑了其在不同时期的动态变化,然而研究区域多选择亚热带湖泊。亚热带地区温暖湿润,蓝藻生长季节较长、种类丰富、易受环境因素影响;在寒区湖泊中,蓝藻群落的季节性变化明显,多样性低,蓝藻丰度通常在夏季达到峰值,并在秋、冬季随着水温下降而降低[8]。黄河流域内蒙古段的寒区湖泊因具有季节性冰封的特点,对蓝藻群落结构、丰度及多样性的影响必然与温暖的不冻湖泊存在差异,但关于寒区湖泊蓝藻的相关研究开展较晚,且更多聚焦在单一时期,冰封期与非冰封期交替的过程中,蓝藻生长和群落演替规律及其对湖泊水质和生态功能的影响机制尚待深入揭示。本研究通过系统地采集寒区多个湖泊水体和底泥样品,结合现代生物技术手段,深入分析蓝藻群落在冰封期与非冰封期的特征变化,为全面理解寒区湖泊生态系统提供科学依据。
1 材料和方法
1.1 湖泊功能差异
考虑岱海、乌梁素海和南海湖3个湖泊地理位置和蓝藻生态分布等特点,结合湖泊水质及现场调查,基于各个湖泊功能区的划分选定3个湖泊的采样点,进行蓝藻样品采集和水质指标的检测。
岱海(40°28′~40°37′N,112°33′~112°47′E)位于内蒙古高原支脉蛮汉山与马头山之间的凉城县一个狭长的陷落盆地之中,海湖面水位平均海拔1224.1 m,光照充足,日照时数最高可达2936.9 h[9],日照率高,降水较少[10],属于深层咸水藻型湖泊[11],其显著特征为水体盐度较高,主要由咸水藻类构成湖泊生态系统的基础。由于盐度的限制,岱海的蓝藻群落与淡水湖泊有所不同,包含耐盐性较强的藻种[12]。岱海的西南部属浅水区,沉积物以沙砾为主,设置采样点D1。湖区东北部地势较为陡峭,增加了该区域的生态脆弱性和水体流动的复杂性,设置采样点D2。湖心区水深较大且底泥淤积较厚,设置采样点D3(图1)。
乌梁素海(40°47′~41°3′N,108°43′~108°57′E)地处后套平原东端,位于内蒙古巴彦淖尔市乌拉特前旗境内,该湖年平均气温为6.5℃,年均降水量为211.53 mm,属于典型温带大陆性干旱气候[13]。湖区整体呈南北狭长、东西狭窄状[14],整体水域面积为285.38 km2[15]。乌梁素海属于北方干旱区典型的浅水草型湖泊,具有调节水量、净化水质、减缓水体富营养化进程以及防止土壤盐碱化等多种生态功能[15]。作为草—藻型湖泊,乌梁素海植被的覆盖和水草的生长对水质和蓝藻群落结构有着重要影响。在湖区总进水渠设置采样点W1,在湖中心区域设置采样点W2,在总排干设置采样点W3(图1)。
南海湖(40°30′8″~40°33′32″N,109°59′2″~110°2′26″E)地处内蒙古的蒙新高原腹地,位于内蒙古包头市东河区南部,水域面积582 hm2,湿生草地面积1000 hm2,气候干旱[16]。南海湖作为典型的城市型湖泊,其生态环境受到了人为活动的显著影响[17],其特点是水体中的无机氮含量远超过其环境容量的承载能力,沉积物中的有机氮污染也相对严重,这种氮素的过度积累为蓝藻的生长提供了有利环境。在南海湖湖区进水处设置采样点记为N1,于南海湖北端和湖心岛附近的旅游区设置采样点N2,在湖中心区域设置采样点N3,在北部芦苇区设置采样点N4(图1)。

图1岱海、乌梁素海和南海湖采样点位置
Fig.1Location of sampling sites in Lake Daihai, Lake Wuliangsuhai and Lake Nanhai
1.2 样品采集及处理
根据3个湖泊实地考察数据及相应的水文水质条件,并参照中华人民共和国环境保护部发布的《水质湖泊和水库采样技术指导》(GB/T14581—1993),在湖泊非冰封期(7月),采用有机玻璃采水器从距表层0.5 m处采集水样。在取样前,确保所有容器均使用蒸馏水进行冲洗。在取样过程中,再次使用湖水对容器进行3次润洗,然后取1 L水样置于聚乙烯广口采样瓶内。进入冰封期后,于1月使用冰上钻冰机进行湖泊冰体的钻冰作业。当接近冰下水体时,为了减少对水体的扰动,改用冰钏彻底凿穿冰层。确保采集到冰下0.5 m处的表层水样,以保证数据的准确性和可靠性。样品的采集时间被严格控制在当天的9:00—15:00。利用multi350i便携式水质分析仪,对水温(T)、水深(WD)、电导率(EC)、pH、溶解氧(DO)和透明度(SD)等水质参数进行现场测定。采集的水样全部放入低温保温箱中避光保存,在48 h内带回实验室检测。总氮、总磷、氨氮、化学需氧量和硝态氮等水环境因子指标根据国标法进行测定[18],具体测定方法见表1。
1.3 DNA提取及宏基因组测序
使用FastDNA© Spin Kit for Soil试剂盒提取水体和底泥微生物总DNA,完成基因组DNA抽提后,利用微型荧光计(TBS-380)检测DNA浓度,利用NanoDrop200检测DNA纯度,进行1%琼脂糖凝胶电泳检测以确保DNA的完整性。通过超声波破碎仪Covaris M220将DNA打断为约400 bp的片段。PE文库构建过程采用NEXTFLEX Rapid DNA-Seq Kit进行,包括接头链接、磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集以及磁珠回收PCR产物得到最终的文库。宏基因组测序由上海美吉生物医药科技有限公司使用Illumina NovaSeq测序平台完成。
1.4 数据分析
在测序完成后,下载蓝藻相关数据,所有数据整理于Excel 2021中,并使用SPSS 22.0进行统计学分析。在属水平上计算蓝藻的Shannon指数、Pielou均匀度指数和Margalef丰富度指数。通过基因的物种分类学注释,对比NR数据库获取样本物种的分类学注释信息,并使用Reads Number计算蓝藻的丰度。
为分析环境因子对蓝藻的影响,选择水温、pH、溶解氧、总氮、总磷、氨氮、化学需氧量和硝态氮作为水环境因子监测指标。采用Canoco软件进行水环境因子与属水平上蓝藻的冗余分析(RDA),以探讨水环境因子与蓝藻丰度的相关性。
表1水环境因子检测方法
Tab.1 Detection methods of water environmental factors

1.5 多样性指数
利用Shannon指数(H′)、Pielou均匀度指数(J)以及Margalef丰富度指数(D)来表征浮游植物群落多样性[19],计算公式为:
(1)
(2)
(3)
式中,Pi为第i种浮游植物的相对个体数,S为样品中浮游植物的总种类数,N为所测样点中计数得到的所有浮游植物总个体数。
1.6 生态位宽度
(4)
式中,Bi表示物种i的生态位宽度;r表示资源梯度;Pij表示物种i在第j个资源状态下的重要值占该种所有资源等级中的重要值总和的比例,Pij =nij/Ni。
2 结果与分析
2.1 不同时期3个湖泊属水平上蓝藻群落组成
对岱海、乌梁素海和南海湖水体冰封期与非冰封期蓝藻属水平进行检测发现,内蒙湖区蓝藻种类组成具有明显的季节性差异,总种类数的整体变化特点为非冰封期水体(152种)> 非冰封期底泥(147种)> 冰封期水体(109种)> 冰封期底泥(103种)(图2)。
蓝藻不同时期的变化对寒区湖泊生态系统产生了显著影响,两者之间的优势蓝藻存在较大差异,显示出各湖泊独特的生态特征。双色藻属(Cyanobium)、聚球藻属(Synechococcus)和细鞘丝藻属(Leptolyngbya)在不同湖泊和不同季节中均展现出较高的优势度,意味着这些藻类在湖泊生态系统中扮演着重要角色。经过对优势蓝藻的筛选和分析,发现存在4种优势蓝藻,分别为微囊藻属(Microcystis)、聚球藻属、席藻属(Phormidium)和细鞘丝藻属,它们与南方湖泊蓝藻冬季下沉、夏季上浮的越冬机制相似。以乌梁素海为例,细鞘丝藻属和席藻属在非冰封期水体中的相对丰度分别为6.33%和4.27%,但在冰封期水体中,它们并不是优势藻类,而在冰封期底泥中相对丰度分别为29.70%和4.66%(图2)。细鞘丝藻属和席藻属在非冰封期主要生活在水体中或水面上,只有少数生活在底泥中。然而,随着时间的推移,当进入冰封期时,具有越冬行为的蓝藻会逐渐进入底泥中,导致越冬蓝藻在冰封期主要分布在底泥中,只有少数存在于水体中。待温度回升到一定程度,湖泊上的冰完全融化,细鞘丝藻属和席藻属会重新浮到水体表层。这种冰封期下沉、非冰封期上浮的越冬机制使得蓝藻能够适应冰封期的环境变化。
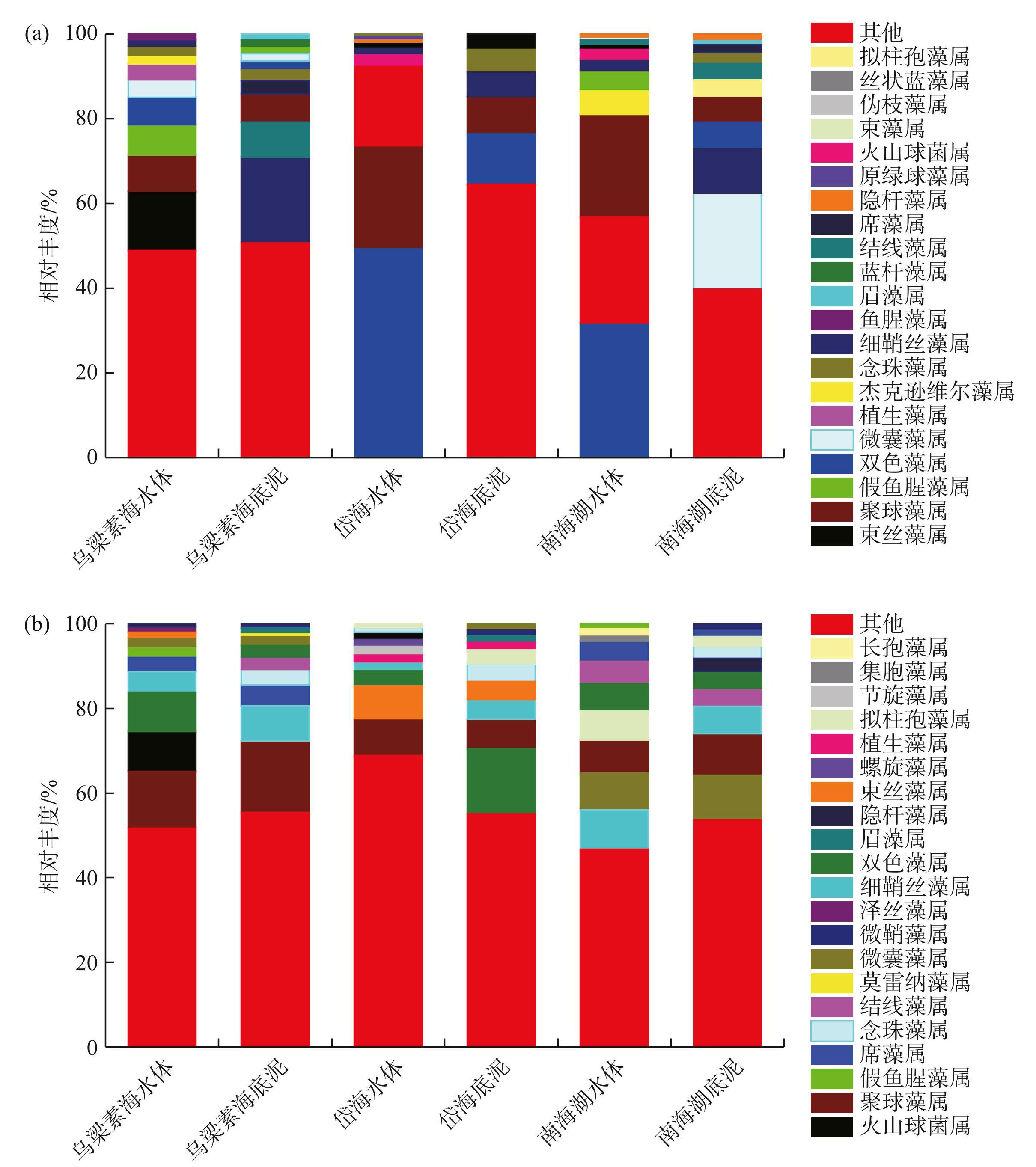
图2冰封期(a)和非冰封期(b)蓝藻在水体与底泥中的相对丰度
Fig.2Relative abundance of cyanobacteria of water and sediment in ice-covered period (a) and non-ice-covered period (b)
双色藻属在冰封期水体中的占比显著高于非冰封期(图2)。这一现象的产生原因主要归结于双色藻属独特的生物学特性,使其在冰封期的湖泊环境中具有显著竞争优势。双色藻属具有卓越的附着能力和获取颗粒有机质(POM)的能力,在冰封期,湖泊中的溶解氧消耗主要依赖于POM的氧化分解[22]。这些POM主要由水生植物和浮游植物在非冰封期产生,并在冰封期间逐渐沉降到湖泊底部。浮游细菌群落中的双色藻属在颗粒附着态细菌群落中占据高丰度,这使其能够有效地附着在POM上,并从中获取更多的碳源和养分[23],在冰封期的水体中具有更高的生存和繁殖优势。因此,双色藻属在冰封期水体中的高丰度可能是通过其能够更好地利用POM作为碳源,并通过附着在颗粒上获取养分的机制来实现的。
2.2 岱海、乌梁素海和南海湖蓝藻群落结构
冰封期及非冰封期岱海和南海湖底泥中蓝藻的Margalef丰富度指数和Shannon多样性指数显著高于水体(P<0.05)。乌梁素海冰封期水体蓝藻的Margalef丰富度指数和Shannon多样性指数显著高于底泥,而非冰封期水体蓝藻的Margalef丰富度指数和Shannon多样性指数显著低于底泥(P<0.05)。岱海冰封期水体的Pielou均匀度指数显著低于其他样点(图3)。
在乌梁素海和南海湖,冰封期底泥和水体中蓝藻群落的Shannon多样性指数、Margalef丰富度指数和Pielou均匀度指数均值普遍高于非冰封期。尽管非冰封期拥有更高的丰度和种类数,但多样性指数综合考虑了物种数目和相对丰度,更注重物种的均匀分布。这种现象可能是非冰封期蓝藻的相对多度不均匀、分布更聚集所致,而冰封期的群落更有利于维持生态系统的稳定性。相比之下,岱海作为深层咸水藻型湖泊,其独特生态环境中的高盐度是导致冰封期水体中蓝藻群落多样性指数较低的重要因素[8],暗示着岱海冰封期水体生态系统的稳定性较弱。
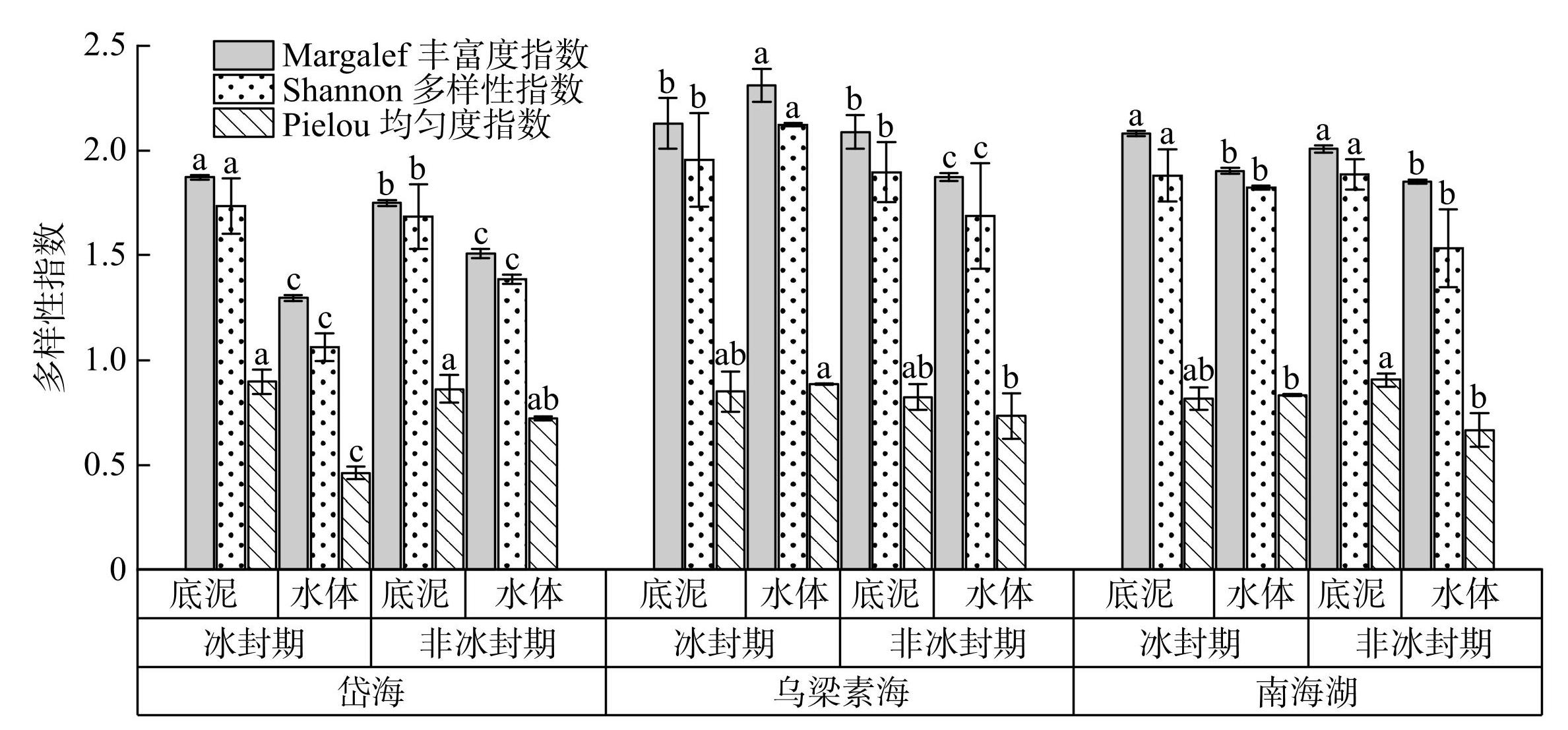
图3不同湖泊群落多样性指标(不同小写字母表示各个湖泊同一指数在不同时期的显著性差异,P<0.05)
Fig.3Diversity indexes of different lake communities
2.3 蓝藻丰度的空间分布
在空间格局上,岱海冰封期湖心深水区D3采样点水体中蓝藻丰度显著高于其他采样点(表2),这是由于在冰封期,湖心深水区的水深较大且底泥淤积较厚,这种环境条件更适合蓝藻的生长。蓝藻通常在富含营养物质的水域中繁殖,而深水区的底泥积累会提供更多的养分供给[24],从而导致蓝藻在冰封期D3采样点中丰度较高。在非冰封期,各采样点底泥中蓝藻的平均丰度显著高于冰封期的原因可能是在冰封期湖泊处于低温状态,直接影响了蓝藻的生长和繁殖。低温环境会减缓蓝藻的代谢活动,降低其生长速度,甚至可能导致部分蓝藻进入休眠状态[1]。岱海作为一个深层咸水藻型湖泊,随着水深的增加,水压增大,氧分子更难逸出水体,溶解氧浓度逐渐降低;深水区域的光照强度在冰封期减弱,光照强度较小,水生植物的光合作用较弱,产生的氧气也相对较少,由此导致冰封期各采样点底泥处蓝藻丰度低于非冰封期。冰封会导致湖泊水体的上、下分层,影响营养物质的垂直分布和交换,限制蓝藻对营养盐和其他生长因子的获取。在非冰封期,随着湖水温度的升高,冰层消融,外源性污染物得以输入湖泊,营养物质从上层水体输入到底泥中。这个过程不仅为蓝藻提供了丰富的营养物质,如氮、磷等,还促进了底泥中有机物的分解和矿化,进一步释放了更多的营养物质供蓝藻利用。
乌梁素海非冰封期水体蓝藻丰度普遍高于冰封期(表2),主要是因为非冰封期时湖面开放,水体中的溶解氧浓度相对较高,有利于蓝藻的生长[25-26]。非冰封期时河套灌区春季灌溉的农田退水携带的氮、磷营养盐可以持续进入湖泊[12],为蓝藻提供充足的养分。 W3采样点底泥蓝藻丰度在冰封期达到最高,而在非冰封期降至最低的原因主要归结为地形、水流速度以及藻类耐寒性的综合影响。湖泊南部流经出水口前的区域为广阔的明水面,地形中间低、四周高[27]。在无风条件下,水流穿越中部芦苇区后流速显著减慢,几乎停滞,这促进了底泥中营养盐的沉积与累积,为藻类生长提供了丰富的养分。尤其在冰封期,乌梁素海冰下的水流速度进一步降低至0.01 m/s[28],远低于非冰封期的0.04 m/s[29],显著减缓的流速加速了底泥营养盐的富集过程。此外,蓝藻相较于其他藻类(如绿藻、硅藻和甲藻)具有更强的耐寒能力[30]。因此,在冰封期,尽管营养盐富集,但由于低温条件限制了其他藻类的生长,蓝藻得以利用丰富的底泥营养盐大量繁殖。相反,非冰封期时,水体流动加快,底泥营养盐富集减弱,且其他藻类在竞争中占据优势,限制了蓝藻的生存空间与资源获取,导致底泥蓝藻丰度降低。非冰封期乌梁素海中心区W2采样点水体中蓝藻丰度显著低于其他采样点的原因可能是湖泊中心区域的水体流动性较弱,导致营养物质分布和交换没有湖岸带或进水、出水处活跃。
南海湖湖区蓝藻丰度总体较高。进水处N1采样点带来了一定量的污染物,为蓝藻的生长提供了营养。由于游客在游览和休闲活动中产生的食物残渣、塑料垃圾和其他有机废物的输入,旅游区N2采样点和湖中心区N3采样点在非冰封期水体中蓝藻丰度较高(表2)。芦苇降解产生的有机物提供了养分,促进了蓝藻的生长,因此北部芦苇区N4采样点的蓝藻丰度也较高。
岱海、乌梁素海和南海湖在冰封期和非冰封期水体和底泥中蓝藻平均丰度均有所不同。在岱海,冰封期水体中蓝藻平均丰度为5.16×105,高于非冰封期(2.52×105),底泥中蓝藻平均丰度在冰封期为6.75×104,略低于非冰封期(8.96×104)。乌梁素海在非冰封期水体中蓝藻平均丰度最高,为1.06×106,而冰封期为5.11×104,底泥中蓝藻平均丰度在冰封期和非冰封期之间差异不大。南海湖非冰封期水体和底泥中蓝藻平均丰度均高于冰封期。
表2蓝藻丰度的空间分布*
Tab.2 Spatial distribution of cyanobacteria abundance
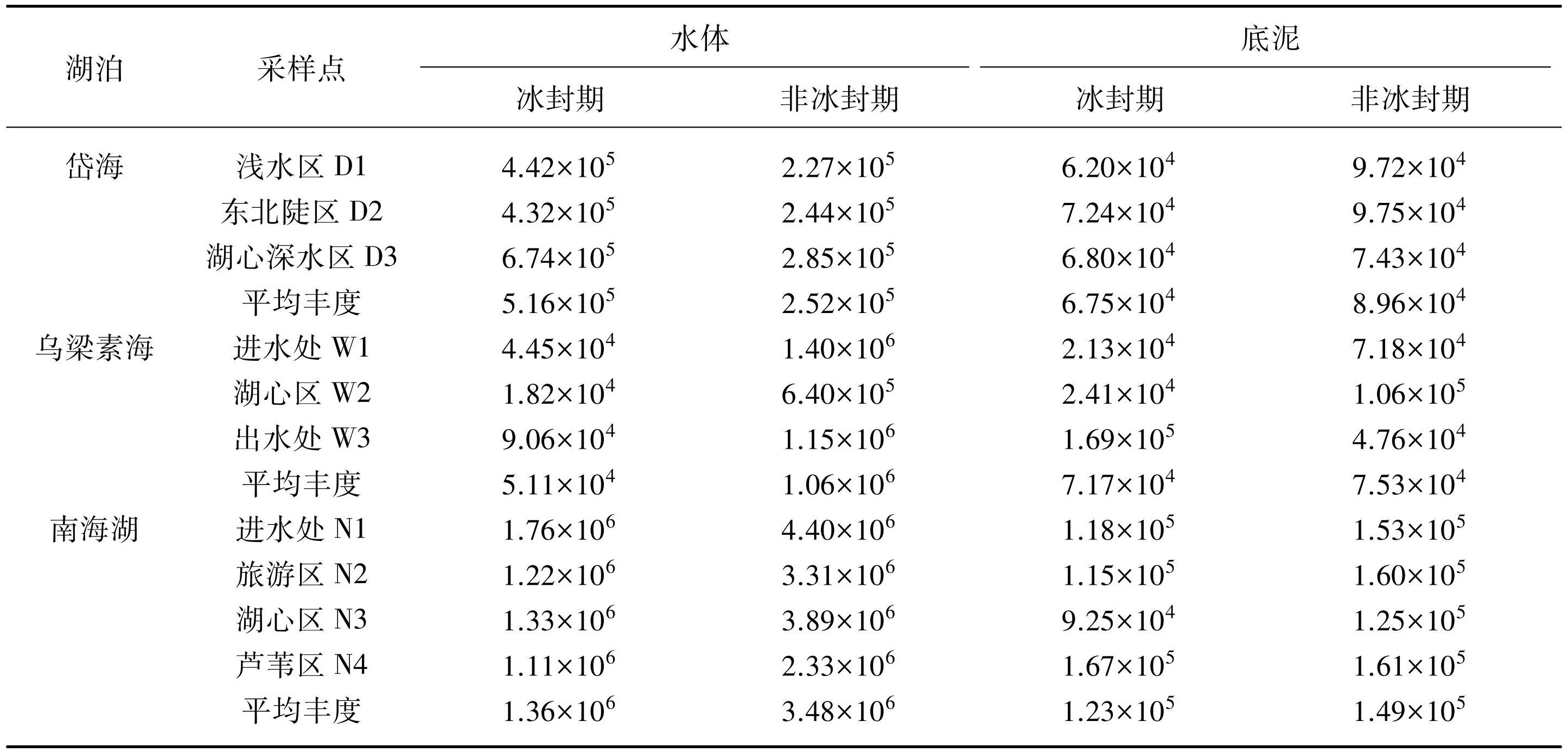
* 表中蓝藻丰度是基于基因的物种分类学注释,比对NR数据库,采用Reads Number丰度计算法,获得每个样本中各个分类学水平的物种和丰度信息。
2.4 优势蓝藻群落生态位特征
生态位宽度是指沿着特定直线穿过生态位空间的距离[31],是种群对资源利用和环境适应能力的综合体现。它描述了物种在环境中生存和资源利用的情况,反映了生物可以利用的综合生态资源指标。生态位宽度很好地反映了物种的分布、种群的生态适应性和资源利用的潜力。生态位宽度较大的藻类物种通常展现出更高的环境适应性和资源利用能力,因而在湖泊中占据主导地位。这些物种能够反映整个藻类的群落结构状况,在生物监测中扮演着重要的角色。相比之下,生态位宽度较小的藻类物种通常与其他生态位相近的藻类物种展现出更强烈的种间竞争,更倾向于生境特化。它们对环境更为敏感,通常作为水域的指示种[32]。通过观察蓝藻的生态位宽度值,可以评估物种对空间资源的利用能力,从而更好地了解其在生态系统中的角色和分布范围。
利用修正的Levins公式计算优势种的生态位宽度,结果如附表Ⅰ所示。冰封期岱海底泥中蓝藻生态位宽度为0.88~0.99,水体中为0.93~0.99;乌梁素海底泥中蓝藻生态位宽度为0.34~0.89,水体中为0.43~0.93;南海湖底泥中蓝藻生态位宽度为0.80~0.99,水体中为0.69~0.99。聚球藻属、微囊藻属、细鞘丝藻属、双色藻属在冰封期岱海、乌梁素海和南海湖不同时期水体和底泥中都是优势属,且岱海和南海湖水体和底泥中的蓝藻群落生态位宽度均在0.8以上,说明蓝藻对研究区冰封期的生境具有很强的适应性。而乌梁素海相较于岱海和南海湖,水体和底泥中蓝藻生态位宽度较低,说明乌梁素海水体和底泥中蓝藻群落环境适应能力较弱,生态适应幅度较小。
在非冰封期,岱海底泥中蓝藻生态位宽度为0.77~0.99,水体中为0.84~0.95;乌梁素海底泥中蓝藻生态位宽度为0.60~0.99,水体中为0.38~0.92;南海湖底泥中蓝藻生态位宽度为0.85~0.98,水体中为0.88~0.97。聚球藻属、细鞘丝藻属、双色藻属在非冰封期岱海、乌梁素海和南海湖非冰封期水体和底泥中都是优势属,这与冰封期相同,且非冰封期岱海和南海湖水体和底泥的蓝藻群落生态位宽度均在0.8以上,说明它们对研究区的生境具有很强的适应性。而乌梁素海相较于岱海和南海湖,水体和底泥中蓝藻生态位宽度相对较低,它们对乌梁素海水体和底泥环境适应能力较弱,生态适应幅度较小。
聚球藻属、细鞘丝藻属在3个湖泊不同时期均为优势种,且在岱海和南海湖水体和底泥的生态位宽度都大于0.8,表明种间相互竞争激烈。聚球藻属适宜在富营养化的水体中生长,且当水体中相对丰度较高时,通常指示该水质较差[33]。在岱海和南海湖中,聚球藻属的相对丰度及生态位宽度均较大,说明岱海[8]、南海湖[17]均长期处于富营养状态。相比之下,乌梁素海的水质则较好[12]。
2.5 蓝藻优势属丰度与环境因子的关系
RDA分析结果(图4)显示,在冰封期底泥中的优势蓝藻丰度主要受到水温、总氮、氨氮和CODCr的影响。冰封期湖泊水温的显著下降对底泥中优势蓝藻的生长产生了一定的抑制作用。低温环境减缓了蓝藻的细胞分裂和代谢活动,即使底泥中积累了较多的养分,蓝藻的生长速度也会受到一定的限制。与此同时,底泥中总氮和氨氮的积累为蓝藻提供了必要的养分,有助于其在冰封期仍能保持一定的丰度。CODCr升高表明有机物可能增加,为蓝藻生长提供了充足的养分。在冰封期水体中,优势蓝藻丰度则主要受到总氮、溶解氧、pH、氨氮的影响。冰封期水体的溶解氧浓度可能会下降,导致水体中的蓝藻面临氧胁迫。此时,蓝藻可能通过调整自身的生理机制来适应低氧环境,同时总氮、氨氮的供应对蓝藻的生长也至关重要。
在非冰封期底泥中,优势蓝藻丰度主要受到温度、溶解氧、氨氮和硝态氮的影响。在非冰封期,随着水温的升高和微生物活动的增强,底泥中的溶解氧浓度增加,为蓝藻的生长提供了良好的条件。同时,氨氮和硝态氮的供应也对蓝藻的生长有重要影响。非冰封期水体中,优势蓝藻丰度主要受到pH和总氮的影响。非冰封期水体的pH变化可能会影响蓝藻的光合作用效率,进而影响其生长速率。总氮作为蓝藻生长的重要氮源,对蓝藻的生长也有显著影响。
无论是冰封期还是非冰封期,水体与底泥中蓝藻丰度的影响因素都表现出一定的差异。这主要是由于水体与底泥的物理化学性质以及蓝藻群落的差异。在水体中,蓝藻的生长主要受到pH、总氮的影响,而在底泥中,蓝藻的生长则更多地受到水温、总氮、氨氮和CODCr的影响。
不同环境因子对不同时期蓝藻群落的影响具有特定的关系。聚球藻属(G3)、席藻属(G10)和细鞘丝藻属(G18)与氨氮呈现正相关关系;聚球藻属(G3)和束丝藻属(G27)与总氮呈现正相关关系;聚球藻属(G3)和细鞘丝藻属(G18)与pH呈现显著正相关关系。湖泊水温、氨氮、总氮和pH是湖泊蓝藻群落特征差异的显著驱动因子[34-38],一般而言,总氮为蓝藻生长和代谢过程提供必须的营养和能量,影响蓝藻的丰度和群落结构。岱海、乌梁素海和南海湖在不同时期受环境因子影响存在差异,这是研究区域范围不同所致。当研究区域范围较大时,湖泊之间环境因子梯度和空间因子梯度差异过大,会影响蓝藻群落结构。
2.6 蓝藻群落的种群装配
生物群落组装机制一直是微生物生态学研究的焦点,生态位理论和中性理论是微生物群落组装的两个重要且互补的机制[39]。生态位理论认为,生物群落受到非生物和生物因素的影响,形成了确定性过程[40];中性理论认为,微生物群落结构是由随机出生、死亡和迁移事件塑造的随机过程[41]。中性理论的随机过程提供了一种补充视角,帮助揭示微生物群落结构中可能存在的随机性因素,促进了对生态系统中微生物多样性和动态变化的深入理解。
从整体来看,非冰封期湖泊水体和底泥(除岱海底泥及南海湖水体)中蓝藻的拟合程度高于冰封期。这表明非冰封期的湖泊水体和底泥更多地受到随机过程的影响,但环境因子仍然是影响蓝藻群落装配的重要因素,环境因子通过影响蓝藻的生长和代谢活动来塑造群落结构。相比之下,非冰封期的岱海底泥和南海湖水体中蓝藻则更多地受环境因素的制约(图5)。

图4不同时期湖泊水体与底泥中优势蓝藻与环境因子的冗余分析
Fig.4Redundancy analysis of dominant cyanobacteria and environmental factors in water and sediment of lakes at different periods
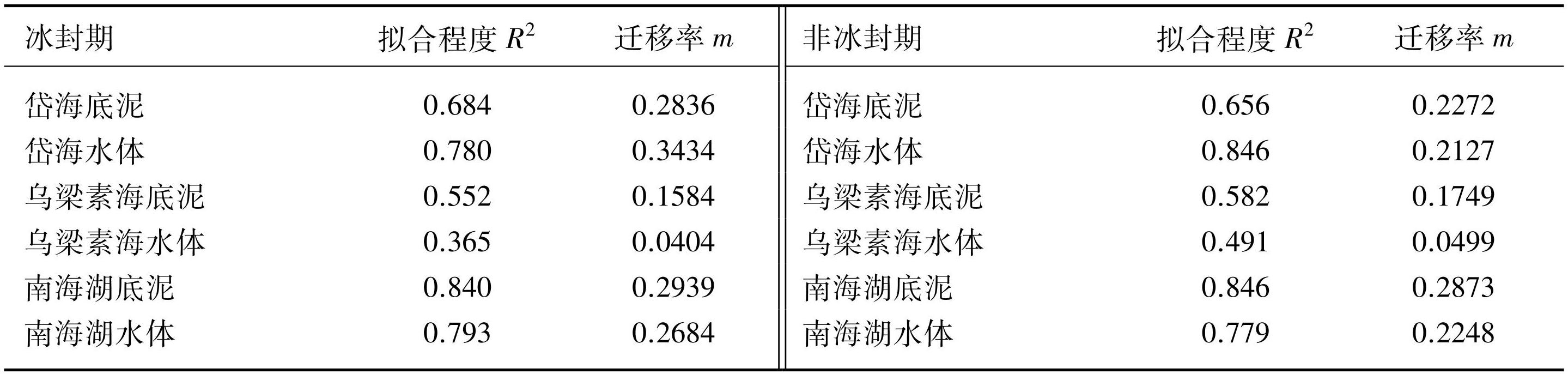
中性模型分析表明,两个时期不同湖泊之间蓝藻的迁移率存在显著差异。整体来看,不同时期下湖泊底泥中的蓝藻迁移率普遍高于水体,不同的是在冰封期时岱海水体蓝藻迁移率高于底泥。
在冰封期,底泥蓝藻的迁移率呈现出南海湖(m=0.2939)>岱海(m=0.2836)>乌梁素海(m=0.1584)的规律,水体的蓝藻迁移率为岱海(m=0.3434)>南海湖(m=0.2684)>乌梁素海(m=0.0404);在非冰封期,底泥和水体中的蓝藻迁移率均呈现出南海湖(底泥m=0.2873,水体m=0.2248)>岱海(底泥m=0.2272,水体m=0.2127)>乌梁素海(底泥m=0.1749,水体m=0.0499)(表3)。
3 讨论
3.1 蓝藻群落变动格局
时间格局上,岱海、乌梁素海以及南海湖的蓝藻种类和丰度在不同时期存在明显差异。乌梁素海和南海湖在非冰封期的蓝藻丰度与种类数显著高于冰封期,产生这一现象的原因主要涉及两个方面。首先,季节的交替导致营养盐可利用性发生变化。乌梁素海流域和南海湖流域种植结构不合理,过量使用的氮肥和农药通过径流进入湖泊,导致氮磷比例偏高,破坏水体的营养平衡,促进蓝藻的生长[42]。但乌梁素海与南海湖的不同之处在于乌梁素海湖泊面积较大,且污染物含量较高的地方主要集中在主排干和上游地区,作为浅水草型湖泊,乌梁素海调节水量、净化水质的能力更强[15,43]。整体而言,虽然非冰封期水中营养物浓度上升,促使蓝藻丰度升高,但并未对湖泊水质造成太大的影响。另一方面,乌梁素海和南海湖非冰封期的平均水温分别为27.1和26.67℃,适宜的温度有助于提高浮游植物的代谢活性,延长其生长时间。随着温度的升高,蓝藻的生长和发育也会被促进。不同藻类具有不同的适温范围,蓝藻和绿藻对于高温(25~35℃)有更强的耐受性,而硅藻则更适应较低温度(15~25℃)[44]。随着温度的变化,部分物种会在季节性生态演替中出现,从而导致蓝藻群落的组成发生变化,因此在非冰封期,乌梁素海和南海湖中蓝藻的丰度和种类数明显高于冰封期。
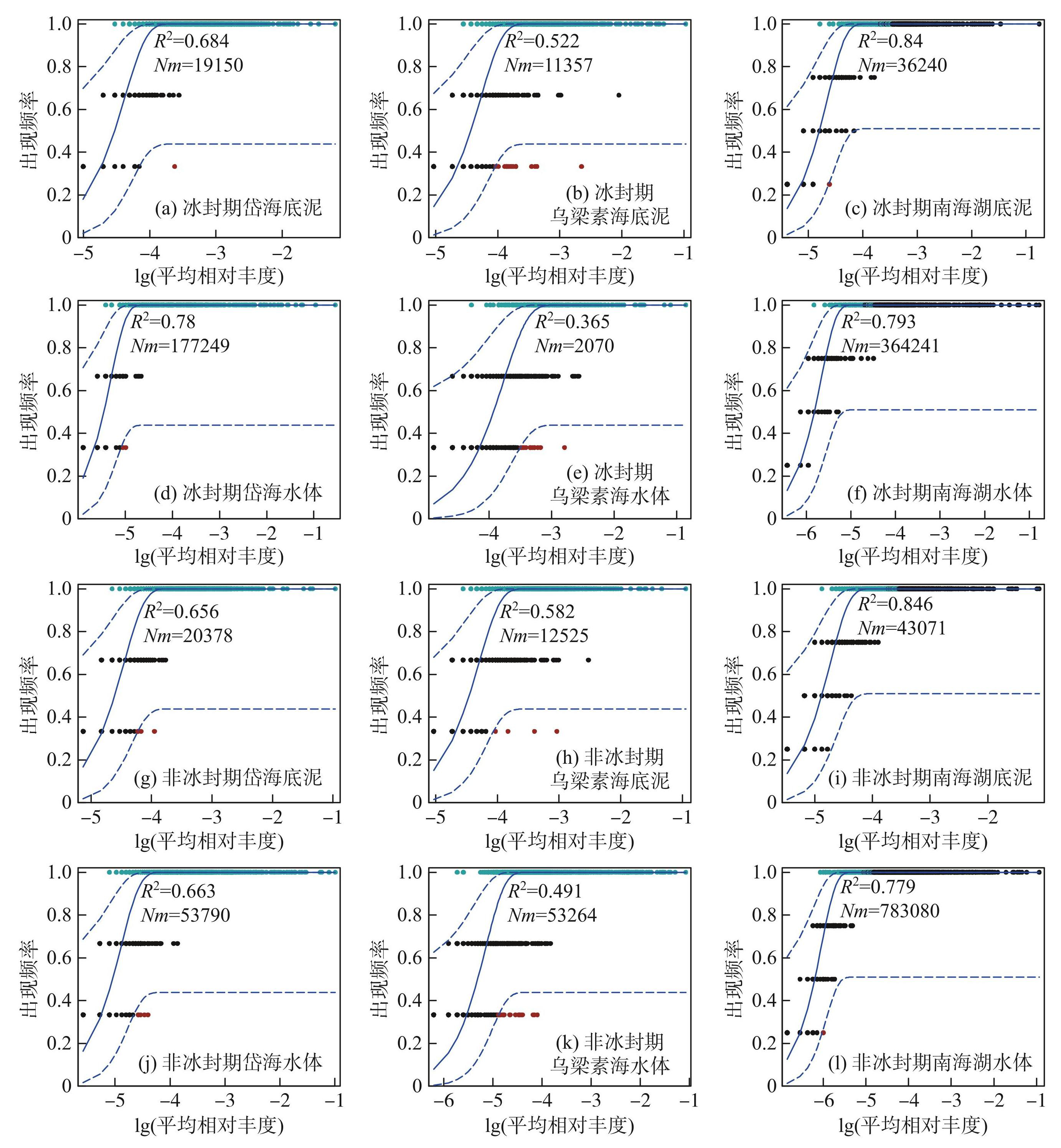
图5岱海、乌梁素海和南海湖基于中性模型的蓝藻OTU出现频率
Fig.5OTU frequency of cyanobacteria in Lake Daihai, Lake Wuliangsuhai and Lake Nanhai based on neutral model
岱海蓝藻在冰封期相对于非冰封期丰度更高,这一独特现象的产生原因主要涉及两个方面。首先,聚球藻作为岱海的优势藻类,其丰度在冰封期与非冰封期之间存在显著差异。根据宏基因测序结果可知,聚球藻在冰封期水体中的丰度显著高于非冰封期。聚球藻对盐度拥有卓越的抗性[45],使其在岱海冰封期水体中展现出极高的均匀分布特性。通过对岱海环境因子进行检测发现,水体中总氮平均浓度从非冰封期的2.91 mg/L升高到冰封期的4.24 mg/L。在这样的环境条件下,聚球藻的生长优势得以充分发挥,可能导致冰下水华现象的发生。其次,冰封期间水体中的氮磷比增加影响蓝藻的分布。蓝藻具有利用高营养盐的生长优势[46],能够在氮磷比增加的环境中获得竞争优势。尽管高盐环境通常对蓝藻不利,但蓝藻对高盐胁迫具有很强的耐受力。在低温高盐的环境下,蓝藻相对于其他竞争物种更能适应环境,因此,在冰封期间蓝藻能够相对较好地生长。据研究发现,冰封前(2020年10月)岱海水体氮磷比为20.7,而冰封期(2021年1月)升高至31.9[47]。因此,蓝藻在冰封期间相对于其他竞争物种更加具有生长优势。
表3中性模型的计算结果
Tab.3 Calculation results of neutral model
3.2 蓝藻丰度变化的影响分析
蓝藻群落结构与环境因子的相关性结果表明,水温、总氮、氨氮和pH是影响岱海、乌梁素海和南海湖蓝藻群落结构的主要环境因子。水温对浮游植物的生长有着重要影响[48],能够直接刺激浮游植物进行光合作用和呼吸作用,从而促进其生长和繁殖[49-51]。水温与多数优势蓝藻种类之间存在明显的正相关关系。蓝藻的生命周期中需要积累一定量的生长积温[52],适宜的温度条件是蓝藻成功繁殖并在自然环境中确立优势地位的关键。水温还与其他环境因子相互作用,水温升高会加剧沉积物营养盐释放[53],促进藻类对氮、磷营养盐的吸收利用[54]。
水体的pH值对蓝藻细胞内化学物质的解离和生理过程具有显著影响。pH值不仅通过调控离子浓度影响环境的盐度,还影响蓝藻对无机盐的吸收和利用效率,这一影响机制进一步作用于蓝藻对二氧化碳的利用速度和光合作用的速率。岱海、乌梁素海和南海湖的pH值长期保持在8以上,这种高pH环境有利于蓝藻等生物发挥竞争优势[55],可能是导致蓝藻成为浮游植物群落中主要组成成分的关键因素之一。pH值作为水体的关键理化因子,不仅直接影响蓝藻的生长和代谢,还与其他环境因子相互作用。pH值的升高可能会降低水体中重金属的毒性[56],从而减轻对蓝藻的胁迫。pH值的变化还可能影响水体中有机物的分解和转化过程,间接影响蓝藻的营养来源。
浮游植物的优势种对TP浓度的响应不明显,但氨氮却对其产生明显影响。这种差异源于3个湖泊中磷浓度满足藻类生长的最低需求(0.02 mg/L)[57],在这种磷浓度下,浮游植物更倾向于利用氨氮进行生长和代谢[58]。其次,总氮和氨氮作为蓝藻生长的重要营养盐,其浓度变化也受到水温、pH等多种因素的影响。水温的升高会加速氨氮的硝化过程[59],影响蓝藻对氮源的利用。pH值的改变也会影响氨氮的存在形态和毒性[60-61],对蓝藻的生长产生影响。
3.3 不同时期蓝藻群落的组装迁移
南海湖在两个时期底泥蓝藻的迁移率普遍高于水体蓝藻迁移率,表明底泥区域蓝藻相较于水体具有更强的扩散能力。一个可能的原因在于,南海湖是一个受污染程度较重的湖泊,周边工业和农业活动排放的废水和废气中含有氮、磷、重金属等,而氮、磷等元素是蓝藻生长的主要营养源[62]。冰封期由于水体凝固,污染物更容易积聚在底泥中,导致底泥区域蓝藻受到更多的污染物影响。蓝藻具有较强的适应能力和生长速度,因此在冰封期更容易扩散到水体中。这表明在南海湖水体中,蓝藻群落的生成不仅受到随机过程的影响,更受到环境因子(如污染物浓度)的强烈影响。另一方面,南海湖水体中丰富的物种也为蓝藻的扩散提供了条件,不同物种之间的相互作用可能会影响蓝藻的生长和扩散。一些研究表明,南海湖底泥中的微生物群落结构可能对蓝藻的扩散起到了一定的促进作用,使得蓝藻在冰封期更容易繁殖和扩散。冰封期岱海水体中蓝藻的迁移率较高,底泥蓝藻的迁移率相对较低,而到了非冰封期,岱海底泥蓝藻迁移率较高,水体的迁移率较低。说明冰封期岱海水体区域蓝藻相较于底泥具有更强的扩散能力,而非冰封期则水体中的蓝藻具有更强的扩散能力。造成这种现象的原因可能是在冰封期,水温下降导致水体密度增加,促进了水体的垂直混合和营养盐的输送[63],为浮游植物提供了更好的生长条件。这样一来,蓝藻在水体中的扩散能力相对较高,而底泥中蓝藻的扩散则受到了较大的限制。但在非冰封期,水温上升导致水体密度减小,垂直混合减弱,营养盐输送减少,浮游植物生长条件变差,导致水体中蓝藻的扩散能力减弱,而底泥中的蓝藻则有更多的生长机会,因此底泥中的蓝藻扩散能力相对较强。这种迁移率的变化表明,岱海中蓝藻群落的生成同样受到随机过程和环境因子的共同作用。乌梁素海两个时期底泥蓝藻的迁移率普遍高于水体,表明底泥区域蓝藻相较于水体具有更高的扩散能力,这可能是因为底泥中的蓝藻具有较强的适应能力和生存力,能够在不同环境条件下生存和繁衍,同时也暗示了底泥环境对蓝藻群落生成的影响。
可以推测3个湖泊中蓝藻群落的生成并非完全随机,而是受到随机过程和环境因子的共同影响。非冰封期湖泊水体和底泥更多地受到随机过程的影响,相比之下,非冰封期的岱海底泥和南海湖水体则更多地受到环境因子的影响。岱海、乌梁素海和南海湖中蓝藻群落的生成是多种因素综合作用的结果,而非单一因素所能解释的,在不同时期和湖泊,这两种因素的作用程度有所不同。未来的研究可以进一步探讨随机过程和环境因子之间的相互作用,以及它们如何共同影响蓝藻群落的生成和变化,为湖泊生态系统的管理和保护提供更为科学的依据。
4 结论
1)在岱海、乌梁素海和南海湖3个不同类型的湖泊中,冰封期和非冰封期对蓝藻群落的影响存在明显差异。在岱海,冰封期水体蓝藻平均丰度明显高于非冰封期,而底泥蓝藻平均丰度则略低于非冰封期。乌梁素海在非冰封期的水体蓝藻平均丰度最高,冰封期则显著降低,非冰封期底泥蓝藻平均丰度略高于冰封期。南海湖非冰封期水体和底泥蓝藻平均丰度均高于冰封期。
2)冰封期和非冰封期蓝藻群落的差异可以归因于不同湖泊的优势蓝藻生态位宽度和对环境适应以及资源利用策略的差异。环境因子如水温、总氮、氨氮和pH对岱海、乌梁素海和南海湖中蓝藻群落结构有显著影响。蓝藻在不同湖泊可能呈现不同的生态位宽度,对环境因子的敏感程度不同。
3)蓝藻群落的变化与环境因素密切相关,同时也受到随机过程的影响。生态位宽度和中性群落模型分析揭示了蓝藻在不同湖泊和季节中的竞争优势和群落结构的差异,蓝藻的迁移动态和分布也受到周围环境因素和气候等多种因素的影响,进一步影响了蓝藻群落的结构和变化。随机过程在非冰封期的湖泊水体和底泥(除岱海底泥及南海湖水体)中扮演了更为重要的角色,在非冰封期,蓝藻群落的分布和变化不仅受到环境因素的制约,还受到随机过程的显著影响。了解蓝藻群落在不同时期的变化规律及其影响因素,有助于制定更为精准的湖泊管理策略。通过监测和调控关键环境因子,可以有效预防蓝藻过度繁殖,维护湖泊水质的稳定与生态平衡。
5 附录
附表Ⅰ见电子版(DOI: 10.18307/2025.0113)。
