摘要
微囊藻水华是最为常见的有害水华。在水华中的微囊藻细胞大多聚集为群体,群体状态对维持其生态优势至关重要。将微囊藻分散成单细胞状态,可削减其竞争优势,作为控制水华的手段。本研究以细菌多糖黄原胶和水华微囊藻(Microcystis flos-aquae)胞外多糖为唯一碳源,筛选出了5株具有利用微囊藻胞外多糖能力的细菌,通过共培养研究这些菌对单细胞状态的水华微囊藻胞外多糖和群体状态的惠氏微囊藻(M. wesenbergii)群体状态的影响。结果显示,对于水华微囊藻,其中4株细菌能够明显地降低胞外多糖的粘度;对于惠氏微囊藻,5株细菌均能显著减小藻群体,并能抑制其生长。这5株菌经16S rDNA鉴定均属于假单胞菌属。研究结果表明,分离获得的菌株有用于防控微囊藻水华的可能性。
Abstract
Microcystis bloom is the most common harmful bloom. Microcystis cells in bloom aggregate into colonies, which is crucial for maintaining their ecological advantage. Dispersing Microcystis into the unicellular form can decrease their competitive advantage, and has been used as a strategy to control Microcystis bloom. In this study, five polysaccharide-degrading bacteria (PDB) with the ability to decompose the extracellular polysaccharides of Microcystis were screened by using bacterial polysacchrides xanthan gum and the extracellular polysaccharides of Microcystis flos-aquae as the carbon sources. The effects of the bacteria on the extracellular polysaccharides of unicellular strain M. flos-aquae, and on the colony size of colonial strain M. wesenbergii were observed by co-culture. The results showed that four strains of bacteria were able to significantly reduce the viscosity of the extracellular polysaccharides of M. flos-aquae. All five strains were able to reduce the colonial size and to inhibit the growth of M. wesenbergii. The PDB were identified to the genus Pseudomonas by 16S rDNA. This study showed that the PDB have the potential to control Microcystis bloom.
Keywords
近几十年来,世界范围内微囊藻水华暴发的频率和范围都在增加,形成了广泛的生态危害[1]。如何有效控制微囊藻水华,是研究者们广泛关注的课题。天然水体中的微囊藻主要以群体形式存在。已有研究表明,群体状态有助于微囊藻获得生态优势。一方面,群体状态的微囊藻有较强的获得营养资源的能力。群体能够帮助微囊藻调节浮力,有利于其在水中较迅速地垂直迁移,从而更好地利用光照和营养盐资源,且较大的群体微囊藻比小群体更有利[2-3]。群体微囊藻易于与周围细菌、真菌和其他微生物结合,促进其对营养物质的利用[4]。群体中更高的多糖浓度也有助于其从环境中富集N、P营养[5]。另一方面,群体状态的微囊藻有更强的抵抗不良环境的能力,包括抵御紫外辐射以及抵抗重金属等有毒物质[6-7]。在大量胞外多糖的裹挟下形成的大群体,也可以有效阻挡浮游动物的摄食以及一些细菌和病毒的侵害[6,8]。微囊藻细胞壁外层的主要成分是胞外多糖,胞外多糖在微囊藻聚集形成群体过程中起决定性作用,它们为藻细胞的聚集提供黏附力[2,9]。
生物操控一直是人们探索控制蓝藻水华的努力方向。关于藻—菌关系,已有的研究多聚焦于利用溶藻细菌抑杀微囊藻[10]。虽然已有很多报道[11-12]筛选出有效的杀藻菌株,但这些研究结果大多是以实验室培养的单细胞状态藻株获得的,迄今未见有效的实际应用。另一方面,如果直接杀死、裂解水华中的藻细胞,有可能会导致水体中有机物浓度迅速增加,使水质恶化。因此需要探寻环境友好、长效的控制方法。本研究旨在寻找能够打破微囊藻群体状态的多糖降解菌,通过抑制微囊藻群体聚集的状态降低其生态优势,为微囊藻水华的生物防治提供新手段。
1 材料与方法
1.1 藻种及培养
实验所用的藻种包括:群体藻株惠氏微囊藻(M. wesenbergii Hui-7),分离自太湖蓝藻水华,本实验室培养保存;单细胞藻株水华微囊藻(M. flos-aquae FACHB-1272),购于中国科学院水生生物研究所淡水藻种库。惠氏微囊藻和水华微囊藻分别在MA[13]和BG-11[14]培养基中,(25±2)℃温度下24 h连续光照培养,光照强度为29 μmol/(m2·s),培养期间震荡摇匀。
初筛培养基(黄原胶培养基)为无碳酸钠的BG-11培养基,加入3 g/L黄原胶(细菌多糖)作为唯一碳源,其中黄原胶购于上海源叶生物科技有限公司。复筛培养基(微囊藻胞外多糖培养基)为无碳酸钠的BG-11培养基,加入3 mg/L提取纯化的微囊藻胞外多糖;固体培养基中加入15 g/L琼脂粉。
1.2 微囊藻胞外多糖提取及测定
水华微囊藻FACHB-1272藻株显著不同于其他藻株,具有很强的产胞外多糖能力。用BG-11培养基培养一段时间后,培养液明显变得粘稠。较长时间(一个月左右)培养后,由于大量多糖累积培养液可变成冻胶状,故本研究以该藻株作为微囊藻胞外多糖的来源。从培养液中回收其胞外多糖用于本研究的多糖实验,具体步骤为:将培养至对数生长期的FACHB-1272于4℃、8000 r/min离心30 min,弃去藻细胞,取上清,加入3倍体积的无水乙醇,于60℃水浴加热10 min,待其冷却后置于4℃冰箱中沉淀过夜。过夜处理后的样品于4℃、8000 r/min离心25 min,弃上清;加入无菌水将其溶解后,再于4℃、3000 r/min离心5 min,弃去沉淀,上清再次加入无水乙醇,重复上述步骤后,得到的上清即为多糖溶液,置于4℃冰箱中保存[15]。
采用硫酸苯酚比色法[16]测定多糖浓度。用干燥至恒重的葡萄糖制备标准溶液并绘制标准曲线:各取0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9 mL葡萄糖标准溶液(质量浓度为0.04 mg/mL)于试管中,用蒸馏水定容至1 mL,同时取等量蒸馏水作为空白对照,分别加入0.5 mL 5%的苯酚溶液,摇匀后迅速加入2.5 mL浓硫酸,再摇匀,静置20 min,于490 nm波长处测定溶液吸光值,以葡萄糖浓度为横坐标、吸光值为纵坐标建立标准曲线。
1.3 微囊藻多糖降解菌的分离与培养
取太湖蓝藻水华水样离心,用无菌BG-11培养基清洗藻体沉淀3次后,加入1 mL无菌BG-11重悬藻体,涡旋振荡5 min后静置,使水样中藻细胞充分沉降。取上清,用无菌BG-11培养基进行梯度稀释,各取100 μL涂布至固体黄原胶培养基上初筛,于30℃恒温培养4 d后,观察菌落的生长状况,并挑取单菌落在固体初筛平板上进行多次分离纯化。
挑选初筛培养基上已分离的长势良好的单菌落,在微囊藻多糖固体培养基上划线复筛,于30℃恒温培养4 d后,重复划线再次进行多糖降解菌的分离与纯化,将最终分离鉴定后的菌株用30%的甘油保存于-80℃冰箱。
1.4 多糖降解菌的分子鉴定
将分离纯化后的单菌落接种于复筛液体培养基中,于30℃、180 r/min摇床培养48 h,以菌液直接作为模板,引物为细菌通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′[17]扩增细菌的16S rDNA。PCR反应体系为:0.25 μL菌液、12.5 μL 2×PCR Master Mix、1 μL 正向引物27F、1 μL 反向引物1492R和10.25 μL超纯灭菌水。PCR扩增的程序为:95℃预变性5 min;95℃变性15 s,61℃退火15 s,72℃延伸1 min;35个循环后,72℃再延伸5 min。取5 μL PCR扩增产物进行1%琼脂糖凝胶电泳检测后,委托北京擎科生物有限公司进行测序。
将获得的序列在NCBI网站(https://www.ncbi.nlm.nih.gov/)中的GenBank数据库中通过Blast比对,查找相似序列进行种属鉴定。选取同源性较高的序列,运用mafft进行多序列比对,经trimAl修剪后,用iqtree构建系统发育树。
1.5 多糖降解菌降解多糖能力测定
将筛选到的细菌接种到以微囊藻多糖为碳源的复筛液体培养基中,于30℃、180 r/min摇床培养48 h后,各取4 mL于8000 r/min离心2 min,分离细菌发酵液与菌体,其中菌体用无菌水重悬。参考1.2节所述方法测定细菌发酵液的初始多糖浓度,作为实验初始多糖浓度的一部分。
配制质量浓度为9.7 mg/L的微囊藻胞外多糖液体培养基,用于测定多糖降解菌及其发酵液降解多糖的能力。实验组一各加入3 mL多糖液体培养基和2 mL细菌发酵液,实验组二各加入3 mL多糖液体培养基和2 mL菌体重悬液(OD600≈ 0.2),于30℃、180 r/min摇床培养36 h后,离心取上清测定多糖终浓度并与初始多糖浓度进行比较,计算降解率。
1.6 多糖降解菌对水华微囊藻胞外多糖的影响
将500 μL水华微囊藻接种至5 mL无菌BG-11培养基中,培养3 d后,取1.5节中液体培养的菌液6 mL(OD600≈0.2)进行离心,得到的菌体沉淀各用600 μL无菌水重悬,向每管水华微囊藻(OD720≈0.5)中加入200 μL菌悬液,对照组用等量无菌水代替。培养20 d后,观察微囊藻生长状况并测定藻液粘度的变化。采用落球机油粘度计(购于利众汽车电子公司)比较实验组和对照组藻液的粘度差异。测定方法为:各取3 mL待测藻液于粘度计测定管中,放入直径约为5.5 mm的小钢球,待钢球沉至底部,翻转粘度计,使各测定管中的小球同时下落,根据小球下落的相对距离,比较藻液粘度的差异。
1.7 多糖降解菌对群体状态惠氏微囊藻的影响
将500 μL惠氏微囊藻接种至5 mL无菌MA培养基中,培养3 d后,参考1.6中所述方法加入多糖降解菌。连续培养20 d,观察惠氏微囊藻的生长状况和群体大小的变化,并于显微镜下观察比较群体大小。将群体微囊藻在涡旋振荡器上震荡使细胞分散后,测定藻液于720 nm处的吸光值,根据公式OD720=8×10-9X+0.0184(X为藻细胞密度,单位:cells/mL)计算藻细胞密度[18]。
2 结果
2.1 微囊藻多糖降解菌的筛选
为筛选出目的菌株,以细菌细胞壁多糖黄原胶为唯一碳源作为筛选培养基,从太湖蓝藻水华洗涤出的附生菌样品中,初筛出能利用细菌多糖的菌株。挑选20个生长较迅速的大菌落,再用微囊藻胞外多糖为唯一碳源的复筛平板划线培养,并挑取生长良好的单菌落进一步划线纯化,最终选取了5株长势较好的微囊藻多糖降解菌,分别命名为TH29-1、TH29-2、TH29-3、TH29-4、TH29-5。
2.2 微囊藻多糖降解菌的分子鉴定
5株微囊藻多糖降解菌的16S rDNA的PCR产物序列长度约为1500 bp。将PCR产物送去测序,测序结果在NCBI中通过Blast程序比对,在GenBank中查找相似性最接近的序列,获得序列号,结果如表1所示。
表1多糖降解菌的16S rDNA的相似性分析
Tab.1 Identification of polysaccharide-degrading bacteria by 16S rDNA

经比对,本实验筛选出的5株微囊藻多糖降解菌均属假单胞菌属(Pseudomonas)。选取同源性较高的序列,比对分析后构建系统发育树(图1)。从图1可见,TH29-1、TH29-2、TH29-4和TH29-5聚在一支,与恶臭假单胞菌(Pseudomonas putida)亲缘关系最近。

图1最大似然法构建的基于多糖降解菌16S rDNA的系统发育树
Fig.1Phylogenetic tree of 16S rDNA of polysaccharide-degrading bacteria constructed by maximum likelihood method
2.3 多糖降解菌多糖分解能力测定
为评价5株菌对微囊藻多糖的分解能力,以水华微囊藻胞外多糖为底物,分别测定5株菌的发酵液和菌体对多糖的分解能力,测定结果列于表2。发酵液降解多糖的效果总体优于降解菌本身,提示发酵液中可能积累了较多分解多糖的酶。其中,菌株TH29-5、TH29-3和TH29-1的发酵液降解多糖能力较强,经过36 h孵育后,微囊藻培养液的多糖浓度明显降低。
表2多糖降解菌对培养液中微囊藻胞外多糖浓度的影响
Tab.2 Effects of polysaccharide degrading bacteria on the concentration of polysaccharides of culture medium

比较加入菌体的降解效果,发现TH29-4和TH29-5表现出了显著的多糖降解作用,而加入TH29-1、TH29-2、TH29-3孵育36 h后,培养液多糖浓度却高于初始多糖浓度,分析原因可能是这3株细菌虽然降解了原本添加的底物多糖,但在生长过程中自身却产生了一定量的胞外多糖。因此这些菌株的降解多糖能力需进一步实验验证。
2.4 多糖降解菌对水华微囊藻胞外多糖的影响
水华微囊藻FACHB-1272为单细胞状态藻株,该藻株在BG-11培养基中生长时会产生大量胞外多糖,培养一段时间后藻液会变的粘稠,甚至可呈果冻状。为验证降解菌与藻共培养状态下对微囊藻多糖的降解作用,将5株多糖降解菌与FACHB-1272进行了共培养,培养20 d后,接种降解菌的藻液与对照组相比颜色明显发黄,藻液粘稠度下降。
为了确认藻液粘度的变化,用小球粘度计测定藻液的粘度差异。经过多次重复实验比较可见,与多糖降解菌共培养的藻液粘度较对照组均有不同程度的下降(表3、图2),其中TH29-1处理过后的粘度下降最显著,TH29-3、TH29-4、TH29-5次之,TH29-2效果最弱。结合表2多糖降解菌及发酵液分解多糖实验的结果可以判断,TH29-1、TH29-3、TH29-4、TH29-5有较强的分解微囊藻胞外多糖的能力。
表3利用落球粘度计测定多糖降解菌共培养后水华微囊藻培养液粘度的改变*
Tab.3 Viscosity changes of the co-cultural medium of M. flos-aquae with polysaccharide-degrading bacteria using a falling ball viscometer

*相对下落距离为相同时间内,实验组与对照组小球平均下落距离之比。

图2与多糖降解菌共培养后水华微囊藻培养液粘度的测定(上图为5株多糖降解菌(TH29-1~TH29-5)与水华微囊藻共培养的培养液,与未添加降解菌的藻培养液粘度比较。图为钢球下落过程的拍照,小球下落越快,表明液体粘度越低)
Fig.2Viscosity measurement of co-cultural medium of M. flos-aquae with polysaccharide-degrading bacteria
2.5 多糖降解菌对惠氏微囊藻Hui-7生长的影响
Hui-7为群体状态藻株,将5株降解菌与Hui-7共培养7 d后,未加入菌株的对照组藻细胞大多悬浮于培养试管中,而加入细菌的实验组中藻体大多沉在试管底部;培养10 d后,加入菌株的实验组试管内的藻体颜色开始变淡、发黄;培养20 d后,观察到藻液颜色差异显著,对照组试管内藻体的颜色明显比实验组的更绿,加入细菌的培养物明显发黄。其中,与TH29-1、TH29-4共培养的藻生长状态最差。比较微囊藻的群体状态可见,与降解菌共培养的藻群体显著减小(图3)。
分别取不同处理的藻液在光学显微镜下观察群体状态,比对发现,对照组生长旺盛,藻液中群体密集(图4A),而与降解菌共培养的藻密度显著降低,单个视野内群体少,且群体较小(图4B~F)。
对群体细胞数目统计的结果列于表4,结果显示5株降解菌均显著减小了群体,其中TH29-4作用效果最强。对照组微囊藻平均每个群体含65.15个藻细胞,TH29-4共培养组单个群体所含细胞数目仅为11.67个,为对照组的18%。
对比各组惠氏微囊藻的生长状况,用分光光度计测定藻液在720 nm波长下吸光值,代入1.7节中给出的公式估算不同多糖降解菌共培养对藻细胞密度的影响,结果列于表5。结果显示,5株多糖降解菌可不同程度地抑制惠氏微囊藻的生长,与对照组相比藻细胞密度降低了66.5%~85.9%,抑制作用最强的菌株是TH29-4。

图3惠氏微囊藻与不同多糖降解菌共培养20 d后的生长状态(A为对照组,即仅加入无菌水处理的惠氏微囊藻;B、C、D、E、F作为实验组,依次是用TH29-1、TH29-2、TH29-3、 TH29-4、TH29-5菌株处理后的惠氏微囊藻)
Fig.3M. wesenbergii co-cultured with different strains of polysaccharide-degrading bacteria in 20 days
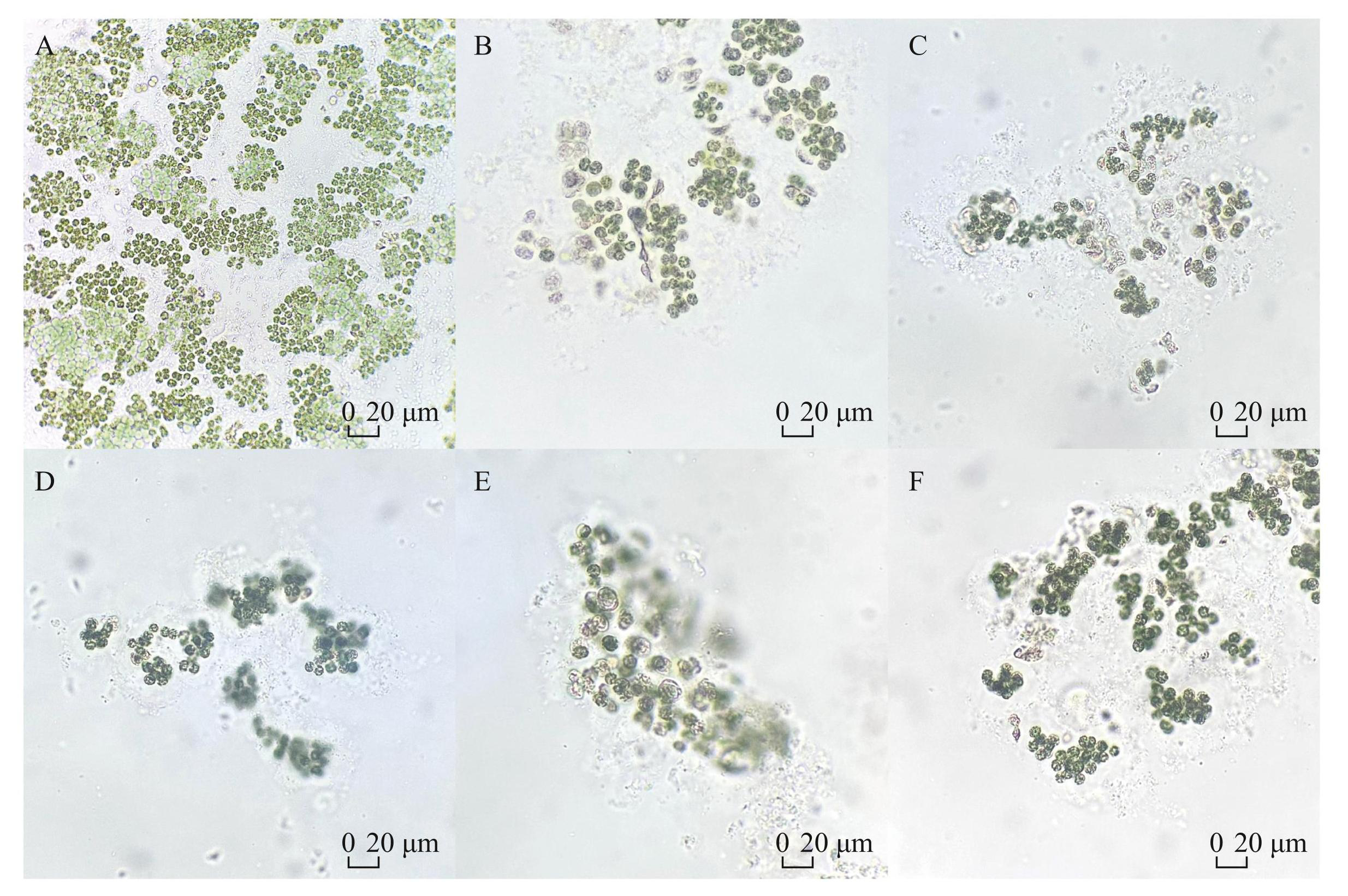
图4惠氏微囊藻与不同多糖降解菌共培养20 d后的群体形态(A~F为显微镜下放大400倍的图像,依次为对照组和用TH29-1、TH29-2、TH29-3、TH29-4、TH29-5菌株处理后的惠氏微囊藻群体形态)
Fig.4Colonial morphologies of M. wesenbergii co-cultured with different strains of polysaccharide-degrading bacteria in 20 days
表4微囊藻多糖降解菌共培养20 d后惠氏微囊藻群体细胞数目
Tab.4 Cell number of the M. wesenbergii colonies co-cultured with polysaccharide-degrading bacteria in 20 days

**表示与对照组差异显著,P<0.01。
表5微多糖降解菌共培养20 d后惠氏微囊藻细胞密度
Table5Cell density of M. wesenbergii co-cultured with polysaccharide-degrading bacteria in 20 days

**表示与对照组差异显著,P<0.01。
3 讨论
群体的形成使得微囊藻获得极大的生存竞争优势,微囊藻细胞分泌的胞外多糖与微囊藻群体的形成和维持有很大的关系,找到合适的方法来降解微囊藻胞外多糖,从而打破微囊藻的群体效应,可作为水华控制的一种手段。细菌和藻类之间的相互作用一直备受关注,它们之间既可以是互惠共生的关系,又可以是寄生的关系,部分藻类周围的细菌还可以抑制藻类的生长[19]。近年来,生物控藻成为研究热点,主要是溶藻菌的分离鉴定,包括假单胞菌属(Pseudomonas sp.)[11]、芽孢杆菌属(Bacillus sp.)[12]及链霉菌属(Streptomyces sp.)[20]等菌类,但从控制群体状态的角度尚未见报到。
在自然水体中微囊藻大多以群体形态存在,群体的形成与胶鞘多糖的分泌密切相关,但是目前对于微囊藻的研究大多以单细胞微囊藻作为实验材料,因为群体形态的微囊藻在实验室培养一段时间后很容易分散成单细胞[21]。本实验以一株长期以稳定群体状态存在、生长较快的惠氏微囊藻为材料,观察并分析了分离获得的多糖降解菌对群体及生长的影响,更有效地反映出多糖降解菌的作用效果。
本实验分离到的5株多糖降解菌,不但显著减小了惠氏微囊藻的群体,也对其生长表现出了显著抑制作用。产生生长抑制效应的原因可能是降解菌对细胞壁多糖的降解影响了藻群体的微观生态环境,从而抑制藻的生长;另一种可能性是这些降解菌产生了抑制藻生长的物质。在之前的研究中,Zhang等从水华水样中分离出一株能够杀死铜绿微囊藻的恶臭假单胞菌[22],可能意味着恶臭假单胞菌在水华水样中较为常见,且具有一定的应用于微囊藻水华治理的潜力。
蔡元锋等[23]的研究表明水体中存在可以降解铜绿微囊藻胞外多糖的菌群,需要强调的是这些降解菌群只存在于微囊藻水华已发生的阶段,可能是水华大量提供了细菌所需有机营养物的结果。本实验从太湖水华水样中筛选到5株细菌,其中TH29-1、TH29-3和TH29-5细菌的发酵液可以有效降低培养基中胞外多糖浓度,显示这3株细菌在生长时会分泌一些分解多糖的酶,而TH29-4菌株可以直接分解微囊藻胞外多糖,研究结果显示不同菌株有不同的降解微囊藻多糖的能力。从运用角度,能以共培养状态抑制微囊藻生长的菌株TH29-4有更好的可用性。
本实验利用多糖降解菌分解胞外多糖,从而使得微囊藻群体显著变小,既可降低其获得光照和营养、抵御不良环境的能力,又可增强动物对其的摄食能力,为微囊藻水华的生物防治措施提供了新的思路。但在野外水体中如何有效运用这些菌株实现控制水华,仍有待进一步的实验探索。
