摘要
溶解有机质(DOM)是水生生态系统的重要能量和营养源,其N/C等元素化学计量学能够反映湖泊沉积物营养物质来源,相关研究有助于揭示全球变暖和水体富营养化的影响机制。本研究聚焦高分辨率质谱技术所获DOM的N/C比值,通过Meta分析从宏观角度考察全球湖泊、河流、海洋和泥炭地等多生境N/C比值的全球分布情况。结果表明,河流水体、沉积物和污水等生境的N/C均值(分别为0.050±0.062、0.050±0.014和0.083±0.084)均显著高于泥炭地(0.026±0.037);水体N/C比值主要受海拔(即温度)、pH、氨氮和溶解有机碳等显著影响,而泥炭地等陆地N/C比值主要受pH、总溶解有机氮和溶解有机碳的影响。进一步,依托云南老君山海拔梯度开展模拟温度变化和营养富集的微宇宙实验定量解析其影响机制,并根据沉积物DOM分子转换数将总分子划分为高活性和低活性两类,探究总分子及其两类组分的N/C比值对温度和营养富集的响应规律。溶解有机质 N/C 均值为0.112±0.020,其中高活性分子(0.119±0.017)显著高于低活性分子(0.109±0.034)。总分子N/C 比值主要受亚硝酸盐和硝酸盐等营养盐的影响,相对总贡献率为63.43%;高活性分子 N/C 比值主要受营养盐和能量供应(比如溶解有机碳、总有机碳和叶绿素a等)的影响,而低活性分子N/C比值主要受营养盐的影响。结构方程模型分析表明,营养富集对总分子N/C 比值的影响高于温度,主要通过能量供应和营养盐的间接作用而产生影响;对于高活性分子,营养盐主要通过能量供应的间接作用影响N/C 比值;而对于低活性分子,主要通过营养盐发挥直接作用。本研究结果首次探讨了全球不同生境N/C比值的分布格局,揭示了沉积物溶解有机质N/C比值对全球变暖和营养富集的响应规律和机制,为更好理解和预测未来全球变化背景下溶解有机碳稳定性提供科学参考。
Abstract
Dissolved organic matter (DOM) is an important source of energy and nutrients for aquatic ecosystems. Its elemental stoichiometry, such as N/C ratios, can reflect the nutrient sources of lake sediments. Its study can help reveal the mechanisms of the impacts of global warming and eutrophication on the water bodies. In this study, we focused on the N/C ratios of DOM obtained by high resolution mass spectrometry, and examined the global distribution of N/C ratios of several habitats such as lakes, rivers, oceans and peatlands by Meta-analysis. The results showed that the mean values of N/C of habitats such as river waters (0.050±0.062), sediments (0.050±0.014) and wastewaters (0.083±0.084) had significantly higher mean values than those of peatlands (0.026±0.037). The N/C ratios of waters were significantly affected by temperature, pH, ammonia nitrogen and dissolved organic carbon, whereas N/C ratios of terrestrial ecosystems such as peatlands were mainly affected by pH, total dissolved organic nitrogen and dissolved organic carbon. Furthermore, to explore the patterns of all molecules and their two fractions in response to temperature and nutrient enrichment, a microcosm experiment with simulated temperature changes and nutrient enrichment was conducted to quantitatively analyze the influence mechanism based on the elevational gradient of Laojun Mountain in Yunnan Province, and classified all molecules into two categories of active and inactive molecules according to the sediment DOM molecular transformation number. The N/C ratio of DOM was averagely 0.112±0.020 for all molecules. The active molecules (0.119±0.017) were significantly higher than inactive molecules (0.109±0.034). The N/C ratios of all molecules were mainly influenced by nutrients (e.g., nitrite and nitrate) with an explanation of 63.43%. The N/C ratios of active molecules were mainly influenced by nutrients and energy supply (e.g., dissolved organic carbon, total organic carbon and chlorophyll-a), whereas the N/C ratios of inactive molecules were mainly influenced by nutrients. Structural equation modelling (SEM) analyses further showed that nutrient enrichment had a greater effect on the N/C ratios of total molecules than temperature changes, mainly through the indirect effects of energy supply and nutrients. For active molecules, nutrients affected the N/C ratios through the indirect effect of energy supply. For inactive molecules, nutrients mostly showed direct effect. Overall, our study explored for the first time the distribution pattern of N/C ratios in various habitats around the globe, revealed the response patterns and mechanisms of sediment dissolved organic matter N/C ratios to global warming and nutrient enrichment, and provided scientific evidence for a better understanding and prediction of the stability of dissolved organic carbon under a changing world.
Keywords
在淡水生态系统中,湖泊是有机物迁移和转化的重要场所[1],湖泊沉积物是主要的有机碳汇,是营养物质生物地球化学循环的枢纽[2],对于维持湖泊生态系统的稳定性至关重要[3-4]。然而,近几十年来,湖泊生态系统正受到人类活动的严重影响[5],比如工业和农业的发展、人口快速增长,极大地改变了营养负荷及其组成,导致湖泊富营养化和全球变暖加剧[6-8],进而影响了湖泊生态系统的健康[9]。生态系统的结构和功能不仅受到人为营养负荷量的影响,还受到营养元素化学计量学的影响[10]。化学计量学作为生态学的一个重要分支,基于热力学第一定律,结合生物进化的自然选择和分子生物学的中心法则,揭示了生物体及其环境间能量(碳)与养分之间的平衡关系[11]。特别是生态化学计量,它描述了生物体及其环境之间的能量(碳)和养分平衡,有助于深入了解环境变化对生物体能量和养分元素循环的影响[12]。以往研究表明,沉积物碳氮比值被认为是衡量湖泊营养状况的一个灵敏指标[13-14]。具体而言,沉积物中低碳氮比(<10)表明来自初级生产的输入,这与高潜在甲烷产生率有关[15];而高碳氮比表明有机物富含多糖或木质素等复杂化合物,同时可能因氮素的不足而限制了微生物降解[16]。溶解有机质(DOM)作为水生生态系统最大、最为活跃的碳库,支撑着湖泊在维持微生物生命活动方面的核心作用[17]。DOM的N/C化学计量比是DOM库的一个重要属性,它既可以影响DOM在水生态系统中的不稳定性和生态作用[18],又可以作为估算有机物对水生环境本土输入量的有效工具[19]。此外,DOM在生物地球化学循环中占据核心地位,作为确定碳源与碳汇的关键因素,不仅在湖泊生态系统中,在陆地和海洋生态系统中也发挥着不可替代的作用[20]。比如,根据全球Meta分析的数据,水生生态系统的DOM数据量占了78%,而其他生态系统可达到22%。因此,研究DOM的N/C比值等化学计量学特征将有利于深入了解淡水生态系统中的碳和氮的生态地球化学循环之间的反馈,对于深入理解湖泊生态系统的结构和功能、环境变化应对、生物多样性保护以及湖泊资源的有效管理都具有重要意义。
不同类型溶解有机质对气候变化和人类活动的响应各异,例如,难降解有机质对温度的响应比易降解有机质更为敏感[21];人类活动通过减少难降解有机质的营养物质来影响其分解,这是由于湖泊营养富集使碳循环过程变得更加复杂[22],进而促进了微生物对活性碳的同化[23-24]。先前研究[25]通过对矿质土壤进行物理和化学分馏将有机质分为3种类型碳库,从最易分解到最难分解,这在CENTURY模型[26]中被称为“快速”“慢速”和“被动”,而在ROTH-C模型[27]中被称为“微生物生物量”“腐殖质有机质”和“惰性物质”。传统分类上认为木质素等不易分解的分子容易在环境中持久存在,而糖类、脂类等易分解化合物则会很快被微生物消耗掉[28]。然而,通过有机质的难易降解程度判断其是否参与生化转化具有一定的局限性,因为其稳定性受到环境影响,比如,在厌氧还原的条件下,易降解化合物(如脂类化合物等)因能量限制而限制其分解;而难降解化合物如木质素在光照作用下可能会转化为不稳定的氧化的或有氧生物的脂肪族化合物[29]。目前,大部分研究通过总有机氮和总有机碳的比(TON/TOC)探究N/C比值,但从分子层面探究N/C比值的研究相对较少。在本研究中,N/C比值是基于聚焦傅里叶变换离子回旋共振质谱(FT-ICR MS)识别的有机质分子式中的氮和碳元素的数量比来确定的,这代表有机质分子的特征,即N/C摩尔比。新近研究根据分子生化转化次数将DOM分子进行划分[30],表征分子活性;即根据分子转化数大小将溶解有机质分子划分为高活性分子和低活性分子[31],其中高活性分子是活跃参与潜在生化转化的分子,而低活性分子则不参与或者极少参与潜在生化转化[30]。通过这种基于有机质活性特征的新颖的碳库划分方法,本研究进一步探究了不同活性碳库N/C比值如何响应温度变化和营养富集。
本文采用Meta分析和微宇宙模拟实验相结合的方式,从全球格局和机制解析两个主要角度,阐释溶解有机质N/C比值受全球分布、数据分布、环境因素和影响机制的影响。首先,通过Meta分析收集了全球953个样本,包含湖泊、河流、海洋和泥炭地等不同生境,聚焦傅里叶变换离子回旋共振质谱(FT-ICR MS)技术解析获取的溶解有机质N/C比值,从宏观角度探究溶解有机质N/C比值的全球分布情况及其影响因素。其次,针对海拔和含氮营养盐与溶解有机质N/C比值显著相关的情况,为探究温度变化、营养富集对溶解有机质N/C比值的单独作用以及两者的交互作用,本文进一步开展了野外水体微宇宙模拟实验,依托中国云南老君山5个不同海拔提供的温度梯度,在5个海拔分别设置10个不同营养水平,模拟温度变化和富营养化。该实验保持初始溶解有机质含量和组成相同,每个海拔定殖当地的微生物群落,经一个月培养后,采集沉积物,采用FT-ICR MS技术分析150个沉积物DOM的分子组成,并根据分子的转换数大小,将DOM分子划分为高活性和低活性两类分子,深入探究溶解有机质分子及其高活性和低活性分子的N/C比值如何响应温度变化和营养富集。本研究旨在解决3个主要问题:(1)探究溶解有机质N/C比值全球分布格局及其驱动因子;(2)分析不同活性特征的溶解有机质N/C 比值随温度变化和营养富集的变化规律;(3)研究不同活性特征的溶解有机质N/C 比值对温度变化和营养富集的响应机制。通过采用Meta分析和微宇宙模拟实验相结合的方式,在全球尺度和机制层面上深入研究溶解有机质N/C比值的影响因素,为水体生态系统的科学管理和保护提供重要的理论基础。
1 材料与方法
1.1 全球各生境N/C比值的Meta分析
使用Web of Science(Core Collection; http://www.webofknowledge.com)和Google Scholar(http://scholar.google.com),通过检索词“dissolved organic matter AND FT-ICR MS”系统地检索了2022年6月之前发表的所有同行评审出版物。选择研究的标准为:(1)拥有原始质谱数据,可据此计算出成分水平的N/C比值;(2)具有成分水平的N/C比值,即特定样本中基于公式计算的N/C比值的加权平均值,其计算方法为每个分子的N/C比值及其相对强度之和除以所有强度之和[20,32];(3)重点研究了从自然环境和工程环境中提取的DOM,而不是操纵实验。共有来自48项研究的953个样本的 N/C比值符合这些标准,所收集的数据集包括水体和陆地,涵盖从热带到冻原的气候区域。进一步将每个系统的数据集细分为不同的生境。具体来说,水体包括海水、海洋沉积物、湖水、湖泊沉积物、河水、河流沉积物、溪流和污水等。陆地包括泥炭地、永久冻土、森林土壤、草地、耕地和河岸土壤等生境[33-34]。
除了N/C比值的数据外,数据集还包括每个样本的气候和环境变量。共收集了15个环境变量,包括盐度、温度、pH值、电导率以及溶解氧(DO)、总有机碳(TOC)、总氮(TN)、总溶解氮(TDN)、溶解有机碳(DOC)、氨氮(NH3-N)、硝态氮(NO-3-N)、亚硝态氮(NO-2-N)、磷酸盐磷(PO3-4-P)、铁(Fe)和锰(Mn)浓度。此外,气候变量利用空间分辨率为0.5°的纬度、经度和数字高程数据得出。
1.2 野外实验研究区域概况
2013年9—10月,选择中国云南老君山(26°41′45.24″N,99°46′33.24″E)开展沿海拔梯度的野外微宇宙实验。老君山位于云南省丽江市玉龙县与大理州剑川、怒江州兰坪等县交界处,属横断山系云岭主脉,属于亚热带气候,年均气温在4.2~12.9℃之间。实验选择5个海拔高度,分别为3822、3505、2915、2580和2286 m;在每个海拔,共设置30个1.5 L的微宇宙,包括用KNO3配制的氮浓度为0、0.45、1.80、4.05、7.65、11.25、15.75、21.60、28.80 和 36.00 mg/L的10个营养水平,设3个平行。微宇宙实验为期28 d,敞口培养。
沉积物来自太湖,经灭菌和均一化处理后加入每个微宇宙,以确保相同的初始溶解有机质供应和组成。每个瓶中装入15 g灭菌沉积物和1.2 L无菌人工湖水,其中灭菌沉积物采集于太湖中心,121℃ 30 min高压灭菌,110℃下干燥24 h,均质后无菌装罐保存待用。用Milli Q灭菌水制备人工湖水,添加CaCl2(7.55 g/L)、MgSO4·7H2O(6.78 g/L)和NHCO3(3.53 g/L)。为促进异养微生物的定殖,人工湖水中同步添加 0.91 g/L葡萄糖。根据太湖2007年水体最高总氮浓度(20.79 mg/L)设置氮营养水平;为补偿氮添加,根据2007年太湖年平均氮磷比(即14.49)添加了KH2PO4,使初始上覆水的氮磷比为14.93。
1.3 野外实验样品采集及溶解有机质化学分析
1.3.1 样品采集
实验结束时,采集上覆水和沉积物,分别为150个,即5个海拔×10个营养水平×3个重复;所获样品随后冷冻保存于-20℃,供后续生物和环境分析。对上覆水和沉积物,共测定16种环境因子,包括水温、上覆水中的pH、NO-2-N、NO-3-N、PO3-4-P和NH3-N;沉积物叶绿素 a、TOC、DOC、TN、总磷(TP);沉积物中溶解态的氮氧化物(NO-x-N)、NO-2-N、NO-3-N、铵态氮(NH+4-N)和PO3-4-P。其中,水的电导率和 pH 值使用移动 pH 计(Sanxin,中国)现场测量。水中的NO-3-N、NO-2-N、NH3-N和PO3-4-P使用流动注射分析仪(Skalar,SA1000)测定[35]。TN和TP分别采用过硫酸钾氧化紫外分光光度法和钼锑抗显色紫外分光光度法测定[36]。相关测定细节参考先前研究[37]。
1.3.2 溶解有机质的提取和测定
沉积物DOM使用苯乙烯二乙烯基苯聚合物柱(PPL)固相萃取进行提取,采用solariX XR 15T 超高分辨率傅立叶变换离子回旋共振质谱仪(FT-ICR MS,Bruker Daltonics,Billerica,MA)。已有研究明确表明,苯乙烯二乙烯基苯类吸附剂(PPL)是提取DOM效率相对较高的方法[38]。FT-ICR MS与电喷雾离子化(ESI)界面耦合等参考文献[39]。具体操作如下:称取0.7 g冻干沉淀物,加入30 mL超纯水充分混匀后超声处理2 h,4000 r/min离心20 min。上清液通过0.45 μm Millipore过滤器过滤,加入1 mol/L HCl调节pH至2左右。用3.5 mL甲醇(ULC-MS 级)冲洗固相萃取柱(PPL柱),并用3.5 mL pH为2的超纯水继续清洗柱子。清洗后,向柱中加入滤液进行萃取。然后继续用3.5 mL超纯水(pH=2)清洗柱子并用超纯氮气吹干萃取柱。最后用甲醇将萃取柱中吸附的有机物洗脱至2 mL棕色样品瓶中,用氮气干燥并储存在-20℃下直至进行DOM分析。具体的DOM分析参考文献[38]。
1.4 溶解有机质分子 N/C 比值的划分
基于FT-ICR MS数据具有超高质量分辨率的特征,根据分子间的质量差与1255个常见的生化转化相关基团的质量数据库进行比较,可推断出分子的生化转化数[40-41]。比如,18.03437的质量差对应于铵基团的损失或增加,而180.06339的质量差可推测为葡萄糖分子的损失或增加。本文根据单个DOM分子的生化转化数来判断其分子活性,生化转化数越高,代表着此分子转化为其他分子的可能性越高,说明其活性相对较高。将16101个溶解性有机质分子进一步划分成两类:高活性分子(2067个,转化数>10)和低活性分子(3691个,转化数≤1)。其依据是,以1次转化为临界值,主要是考虑到每个分子中的转化数较小,且确保有足够数量的低活性分子可用于统计分析。由于生化转化数>1且≤10的分子与转化数≤1的分子随环境因子的变化程度相似,而与转化数>10的分子有很大不同。因此,本研究主要聚焦生化转化数≤1与转化数>10的分子,将转化数≤1和>10的分子分别视为“低活性”分子和“高活性”分子。总体而言,共有溶解有机质总分子、高活性分子、低活性分子3类分子[29]。
1.5 数据处理
本文首先对Meta分析数据做密度图和线性拟合,从宏观角度探究全球不同生境的溶解有机质N/C比值分布及其环境影响因素。由于存在数据集大的正态分布问题,本文对环境因子数据进行了对数转换,以改善其对正态分布的逼近。然后,通过野外微宇宙控制实验聚焦海拔(即温度)和营养富集这两个环境因素探究其对N/C比值的影响机制。
聚焦溶解有机质总分子、高活性分子和低活性分子组成,探讨其N/C 比值在分子水平上随海拔和营养富集的变化规律。首先用密度图直观地展示了溶解有机质总分子、高活性分子和低活性分子的 N/C 比值分布。其次,通过线性模型研究不同活性特征分子 N/C 比值与海拔梯度和营养富集之间的关系。
为了评估不同环境因子对不同活性特征分子N/C比值的相对重要性,将解释变量划分为以下主要驱动因素类别:温度变化(即海拔)、营养富集(即实验添加的硝酸盐和磷酸盐)、营养盐和能量供应。具体而言,营养盐主要包括沉积物中的TN、TP、NO-x-N、NH+4-N、NO-2-N、NO-3-N和PO3-4-P,上覆水中的NO-2-N、NO-3-N、PO3-4-P和NH3-N。在能量供应方面,考虑沉积物TOC、沉积物DOC、水体pH 值和沉积物叶绿素a。根据早期的研究,水体的pH值与沉积物中叶绿素a含量呈显著正相关[37]。由于pH值的测定既方便又准确,因此本研究也采用pH值作为代理指标来反映由光合作用导致的能量供应强度[37]。使用Spearman相关性探讨不同活性特征分子N/C 比值与环境变量之间的关系。
使用随机森林和结构方程模型这两种统计方法探讨环境因子对不同分子N/C比值的影响。首先,本研究使用随机森林模型来确定预测溶解有机质总分子、高活性分子和低活性分子N/C比值的主要环境因子。随机森林模型可以定量地衡量每个解释变量的相对重要性。对于不同活性特征的分子,本研究将所有环境变量都视为解释性预测因子。其次,采用结构方程模型(SEM)方法[42]来检验和量化环境变量与不同活性特征分子的N/C比值之间的直接和间接作用关系。在SEM分析中,间接作用被定义为一个变量通过某一中介变量对另一个变量产生的间接影响。为了量化这种间接影响,一种常用的方法是采用路径系数乘积法。先建立一个包含所有因果路径的初始模型,然后通过临界比率检验每个路径系数的显著性,并逐步去除不显著的路径,直至所有剩余路径均显著为止。通过这一过程,结构方程模型可用来分析4种环境类别对溶解有机质总分子、高活性分子和低活性分子N/C 比值的直接和间接作用。为了在多个预测因子和模型之间进行比较,所有环境变量在建模前都进行了Z 值转换。使用综合变量来考虑温度变化、营养富集、营养盐和能量供应变化的共同影响,每个综合变量的指标都是根据N/C比值的多重回归结果选定的。使用AIC和总体模型拟合统计量来检查所有备选模型,选择AIC值最低的作为最终模型[31]。
所有统计分析和绘图均在R V4.3.1中进行,使用的软件包包括vegan V2.5-6、ggplot2 V3.2.1、randomForestSRC V2.9.1、lavaan V0.6-5 和 RColorBrewer V1.1-2。
2 结果
2.1 全球N/C比值分布特征及主要环境因子
通过Meta分析,收集湖泊、海洋和河流水体,沉积物以及泥炭地等全球来自48项研究不同生境953个样本中DOM的N/C比值。结果表明,水体和陆地N/C比值分布范围存在差异。泥炭地N/C比值分布范围为0~0.213;海洋水体和河流沉积物的N/C比值分布范围相对较小,分别为0.003~0.140和0.002~0.075;而河流水体、污水的N/C比值相对较大,分别为0~0.524和0.015~0.540;另外,湖泊水体的N/C比值为0.0003~0.230,与泥炭地相近。此外,湖泊水体、海洋水体、河流水体、沉积物、污水和泥炭地的N/C比均值分别为0.033±0.039、0.043±0.040、0.050±0.062、0.050±0.014、0.083±0.084和0.026±0.037(图1a),且湖泊的N/C比均值显著高于泥炭地,低于河流水体、沉积物和污水。
由图1b可以看出,随着海拔升高温度降低,河流水体和沉积物的N/C比值均呈显著上升趋势(R2=0.098,P<0.001;R2=0.13,P<0.001);而河流水体N/C比值随年均温升高呈显著上升趋势(R2=0.028,P<0.001)。此外,湖泊水体、河流水体与泥炭地N/C比值均受DOC的显著影响。湖泊水体N/C比值随DOC的升高而升高(R2=0.68,P=0.0065),而河流水体和泥炭地N/C比值则随DOC的升高而降低(R2=0.18,P<0.001;R2=0.15,P=0.0064)。进一步分析显示,大部分生境的N/C比值均受到含氮营养盐的显著影响。例如,河流水体、污水与泥炭地N/C比值分别随TN、NH3-N和总溶解有机氮(TDN)的升高而显著降低(TN:R2=0.21,P=0.042;NH3-N:R2=0.51,P=0.0025;TDN:R2=0.47,P=0.012)。此外,海洋水体和泥炭地N/C比值均与pH呈显著正相关(R2=0.53,P=0.038;R2=0.16,P=0.016,图1b)。
通过Meta分析收集的不同生境DOM的N/C比值均采用FT-ICR MS技术分析且均计算加权平均值。结果表明,湖泊N/C比值与河流、污水和泥炭地N/C比值之间存在显著差异;此外,与环境因子的线性模型表明,湖泊主要受DOC的影响,而河流主要受温度的影响,污水和泥炭地则主要受营养盐的影响。收集到的数据包含953个样本,涵盖从热带到冻原的气候区域。但是,此Meta分析也存在一些特点或不足,比如:(1)湖泊沉积物、海洋沉积物以及高山和冰川等生境的研究数据量较少;例如仅收集到5个关于湖泊沉积物N/C比值的数据,表明湖泊沉积物DOM的研究有待加强。此外,沉积物中DOM与整个湖泊的碳埋藏密切相关,介导着沉积物的碳与水体的碳间的交换和相互作用。(2)先前研究通过对矿质土壤进行物理和化学分馏将有机质分为3种类型碳库,从最不稳定到最难以分解;而新近研究提供了新的分类方法,即可在分子层面通过其转化数大小分成高活性分子和低活性分子,但此新方法尚无研究从N/C比值方面进行探讨,故需要对原始数据开展研究。(3)收集到的N/C比值数据因生境不同,受环境因子的影响也存在差异,往往环境因子间相互关联,无法定量对不同生境造成差异的相对作用,无法解析单个环境因子的绝对作用,更难以解析在其他环境因子共同作用下的相对作用强度。因此,亟需开展环境因子控制下的模拟实验,通过这一重要途径解析DOM的 N/C比值对环境变化的响应规律及机制。
2.2 溶解有机质分子N/C比值的分布规律
通过山地微宇宙实验,在150个沉积物样品中共检测出16101个不同的溶解有机质分子;其中,高活性分子和低活性分子数量分别为2067和3691,相对丰度分别为12.84%和22.92%。这一结果与各个样品中的两类分子相反,比如,在每个样品中高活性分子的数量显著高于低活性分子(P<0.05,ANOVA检验),且高活性分子的数量分布较低活性分子而言更离散(图2)。
研究进一步表明,溶解有机质总分子N/C比值分布范围为0.079~0.180,高活性分子分布范围为0.089~0170,低活性分子分布范围为0.054~0.270(图2a)。此外,高活性分子的平均N/C比值及中值均显著高于总分子和低活性分子(P<0.05),且低活性分子的N/C比值分布较其他两类分子离散(图2b)。具体而言,溶解有机质总分子的平均N/C比值和中值分别为0.112±0.020和0.103;对于高活性分子和低活性分子而言,其平均N/C比值分别为0.119±0.017和0.109±0.034,N/C比值中值分别为0.114和0.105(图2a)。
2.3 溶解有机质分子N/C比值随温度和营养富集的变化规律
沿着海拔梯度和营养富集梯度,DOM分子 N/C 比值呈现了显著且截然相反的趋势。具体而言,总分子和低活性分子的N/C比值均随海拔梯度无明显变化趋势,而高活性分子的N/C 比值与海拔梯度呈现显著正相关(P<0.001,图3a~c)。其中,最低海拔和最高海拔的高活性分子N/C比值间相差0.015,提高了约12.65%。此外,不同活性特征的溶解有机质分子N/C比值均随着营养富集梯度的增加而显著降低(P<0.001,图3d~f)。对于总分子而言,最高营养浓度与最低营养浓度间N/C比值相差0.024,下降约18.65%;而高活性分子相差0.034,下降约24.22%。值得注意的是,低活性分子N/C比值也受营养富集的影响,比高活性分子相关性偏弱(图3e~f)。
2.4 溶解有机质分子N/C比值对温度和营养富集的响应机制
为了深入了解不同活性特征的溶解有机质分子N/C比值的驱动因素,共考虑了16个环境要素,这些环境要素可被分为4类:气候变化(温度)、营养富集、能量供应和营养物质(图4)。
首先,分析了不同活性特征的溶解有机质分子中的N/C比值与水体或沉积物各环境因子的Spearman相关性(图4a)。结果表明,沉积物的DOC(ρ=0.49)、上覆水中的NO-3-N(ρ=-0.53)、NO-2-N(ρ=-0.58)以及沉积物中的PO3-4-P(ρ=-0.54)都是显著影响DOC分子N/C 比值的关键因素。此外,虽然低活性分子也受环境因子的显著影响,但其N/C比值与环境因子的相关性比高活性分子弱(图4a、b)。其中,上覆水中的NO-3-N(ρ=-0.61)、NO-2-N(ρ=-0.69)和pH值(ρ=-0.63),以及沉积物中的PO3-4-P(ρ=-0.60)均显著影响高活性分子的N/C比值(P < 0.05)(图4a);而低活性分子N/C比值主要受DOC(ρ=0.28)、沉积物中的NO-2-N(ρ=0.45)和NH+4-N(ρ=0.34)的显著影响(P < 0.05)(图4a)。
其次,通过采用随机森林模型(图5)分析了温度、营养富集、能量供应和营养物质对N/C 比值的相对贡献。结果表明,溶解有机质总分子N/C比值主要受能量供应和营养盐的影响,其相对总解释量分别为36.57%和63.43%;其中影响最大的是DOC和上覆水中的NO-2-N,其相对贡献率分别为33.49%和31.89%(图5a)。高活性分子N/C比值也主要受能量供应和营养盐的影响,其相对总贡献率分别为43.03%和54.76%;其中解释量较高的也是上覆水中的NO-2-N和沉积物中的DOC,相对贡献率分别为32.11%和24.03%。然而,低活性分子N/C比值主要受营养盐的影响,其相对总贡献率为90.08%;其中上覆水中的NO-3-N和NO-2-N相对贡献率更高,分别为27.62%和26.38%(图5b)。与前面结果类似,温度对溶解有机质总分子和低活性分子的N/C比值影响较小。
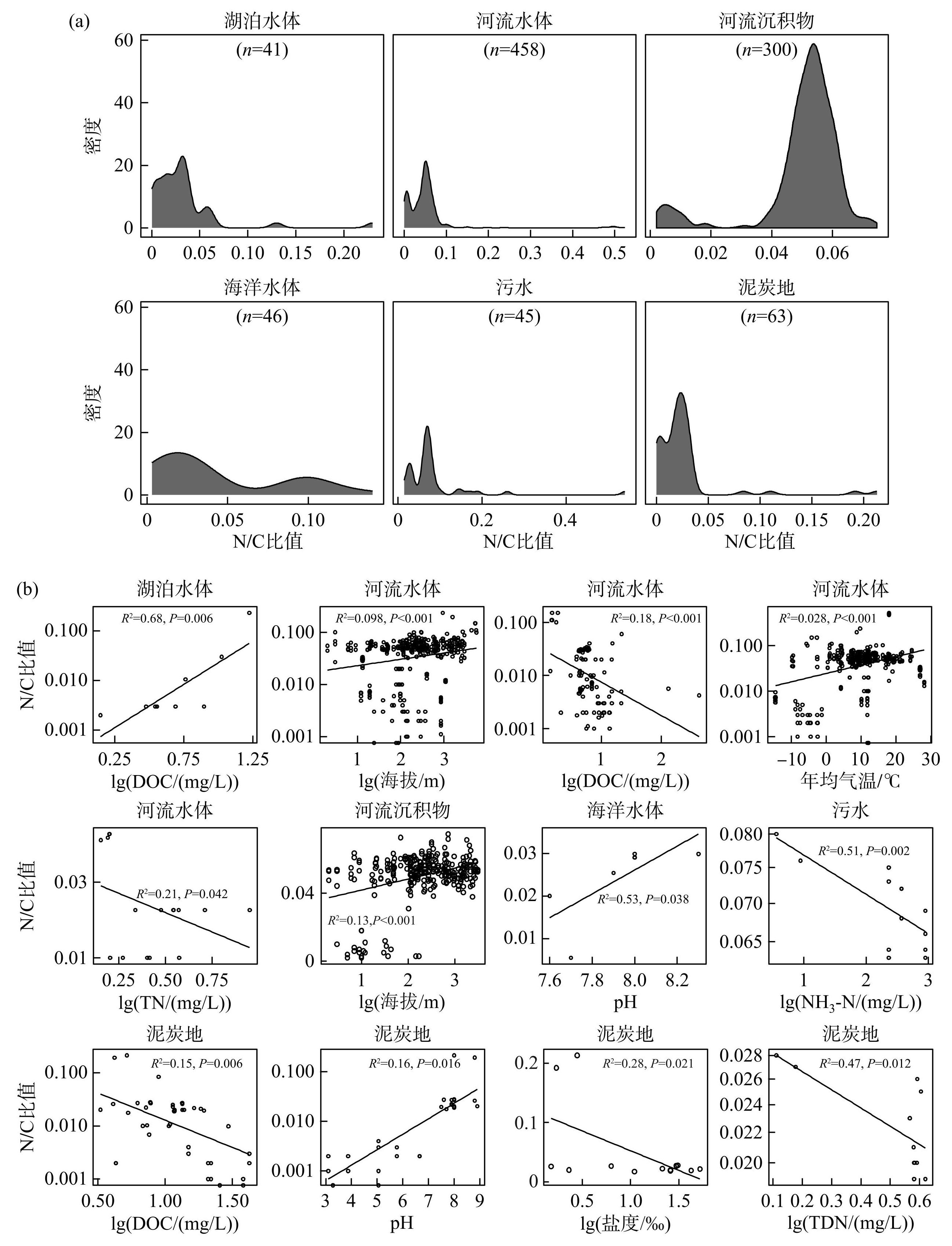
图1基于Meta分析收集不同生境的N/C比值分布情况及其随环境因子的变化趋势
Fig.1Distribution of N/C ratios in different habitats and their trends with environmental factors were collected based on Meta-analysis
最后,通过结构方程模型评估了温度变化和营养富集对不同活性特征溶解有机质分子间的N/C比值的直接影响,以及通过改变营养盐和能量供应的间接影响(图6)。结果表明,溶解有机质总分子和高活性分子的N/C比值均受到营养盐和能量供应的直接影响,而低活性分子也主要受营养盐的直接影响,这与随机森林的结果一致。营养富集对N/C比值的总体影响高于温度,主要通过营养盐和能量供应的间接作用影响N/C比值。但是,不同活性特征溶解有机质分子的 N/C 比值受到温度和营养富集的影响途径各有差异。具体为,温度对总分子N/C比值产生的直接影响为-0.14;而营养富集对总分子N/C的影响主要是通过营养盐的间接影响(-0.38)(图6a)。对于不同活性特征的分子,温度对高活性分子N/C比值的影响主要是通过能量供应的间接影响(-0.14);而营养盐主要通过能量供应的间接影响(-0.41)(图6b)。值得注意的是,温度和营养富集也能影响低活性分子N/C比值,且都主要通过营养盐的间接作用影响(-0.10和-0.24)(图6c)。总而言之,对于不同活性特征的分子,营养富集的影响大于温度的影响,这与图3的线性拟合结果一致。

图2总分子、高活性分子和低活性分子N/C比值的分布(图b中****表示差异显著,P<0.0001;图c中不同小写字母表示差异显著,P<0.05)
Fig.2Distribution of N/C ratios for all, active and inactive molecules
3 讨论
目前,探究N/C比值主要有两种方法:利用总有机氮和总有机碳比值(TON/TOC)从总量上表征N/C比值[43]和通过FT-ICR MS 分析得出N/C比值。传统而言,从总量上使用TON/TOC表征N/C比值。比如,对黄海表层沉积物的研究表明,N/C比值的分布范围为0.08~0.19(C/N比值为5.4~12.8)[44];对富营养化浅水湖泊沉积物的N/C比值研究结果表明,N/C比值范围为0.11~0.14(C/N比值为7.19~9.40)[2]。然而,随着FT-ICR MS技术的发展,人们可以深入到分子层面去探讨N/C比值,借助化合物加权平均法(CWM)精确地计算出样品水平的N/C比值。相对传统的TON/TOC方法而言,该方法可高效快速地获取各类元素比值,比如N/C、S/C、H/C和O/C等[33]。尽管如此,目前仍鲜有研究全面探索溶解有机质N/C比值的全球分布格局、环境驱动因素及其影响机制。
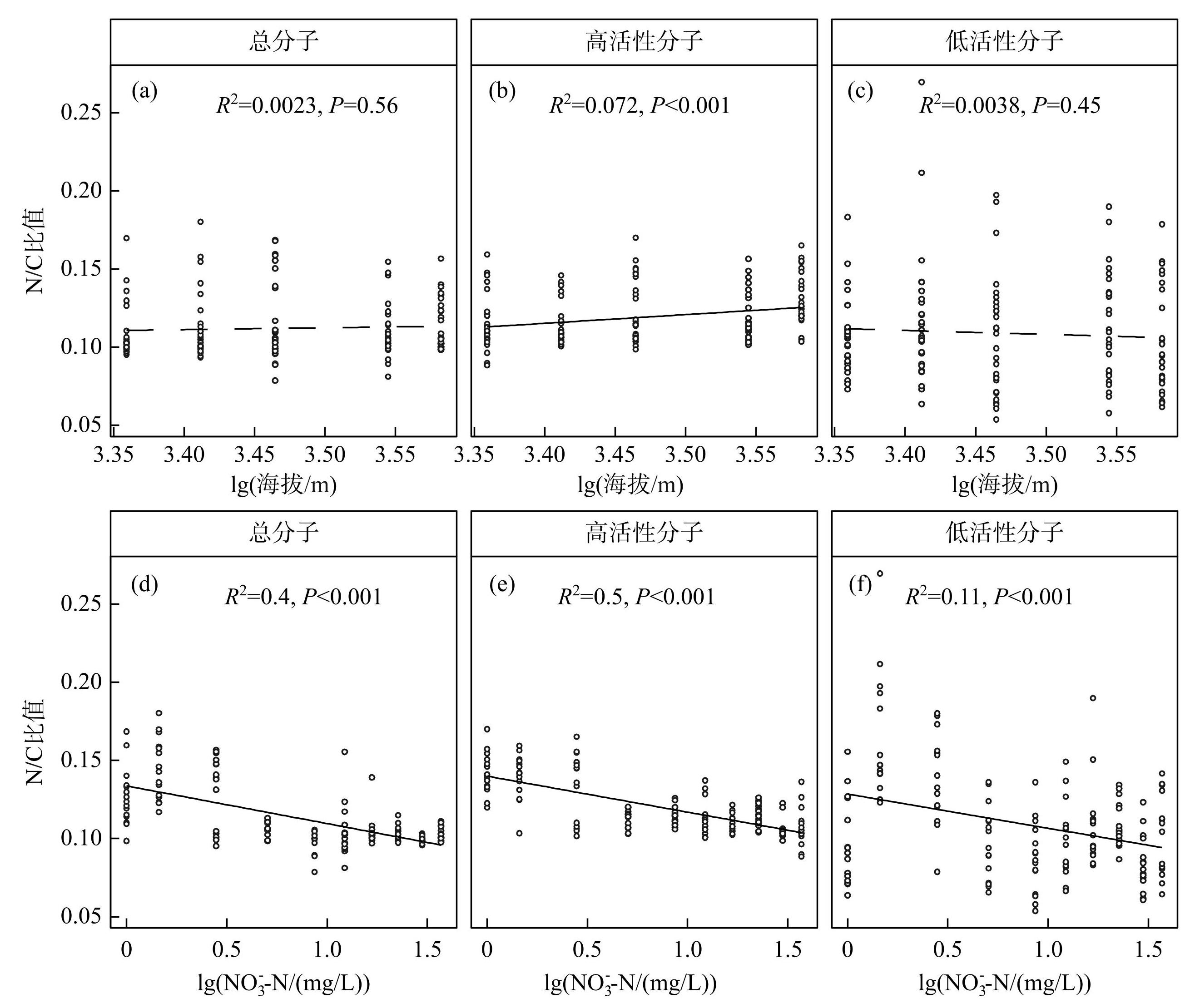
图3总分子、高活性分子和低活性分子N/C比值分别与海拔和营养富集(以添加的KNO3得到NO-3-N浓度表征)的线性回归关系
Fig.3Linear regression of N/C ratios for all, active and inactive molecules with elevation and nutrient addition, respectively
通过整合全球湖泊、河流、海洋和泥炭地等不同生境高分辨率质谱数据,开展溶解有机质N/C比值的Meta分析。结果表明,湖泊水体N/C比均值为0.033±0.039,显著低于河流水体、河流沉积物和污水,其均值分别为0.043±0.040、0.050±0.062和0.050±0.014;而与海洋和泥炭地无明显差异(图7),这可能是有机物的来源不同导致的。河流和污水中有机物主要来源于外源输入,如农业径流中的肥料残留和工业废水等,含有较高水平的氮[45];湖泊中的有机物主要来源于内源生产(如水生植物和藻类的分泌物及其残体)[46],这些有机物往往富含碳而氮相对贫乏[47]。湖泊、海洋和泥炭地中的DOM可能具有相似的来源和降解过程,比如陆源输入,湖泊周围的土壤由于其丰富的有机质含量和茂盛的植被覆盖,且这些有机物质可能会通过地表径流进入湖泊,从而导致湖泊N/C比值与海洋和泥炭地无明显差异[48]。此外,湖泊水体N/C比值受溶解有机碳的显著影响,河流水体及沉积物主要受温度的显著影响,污水主要受氨氮的影响。在模拟体系中,湖泊沉积物N/C比值的均值为0.112±0.020(图7),但鉴于Meta分析中湖泊沉积物的数据极为稀少,相关的对比研究有待深入。
本研究进一步开展基于DOM分子活性特征的分类研究,发现总有机碳与高活性和低活性分子间存在显著差异,表明有必要开展这类活性分类研究。上述显著差异主要包括以下几点:(1)高活性分子的N/C比均值显著高于总分子;(2)高活性分子N/C比值随海拔升高而显著上升,而总分子与海拔间无显著变化;(3)总分子主要受溶解有机碳的影响,高活性分子主要受溶解态亚硝酸盐的影响,低活性主要受溶解态硝酸盐的影响,解释量分别为33.49%、32.11%和27.62%;(4)温度变化和营养富集均可直接影响总分子的N/C比值,也可通过营养盐和能量供应对其产生间接影响;对于高活性分子,营养富集可以通过营养盐和能量供应对其产生直接和间接影响;而对于低活性分子,温度变化和营养富集仅可以通过营养盐对其产生间接影响。
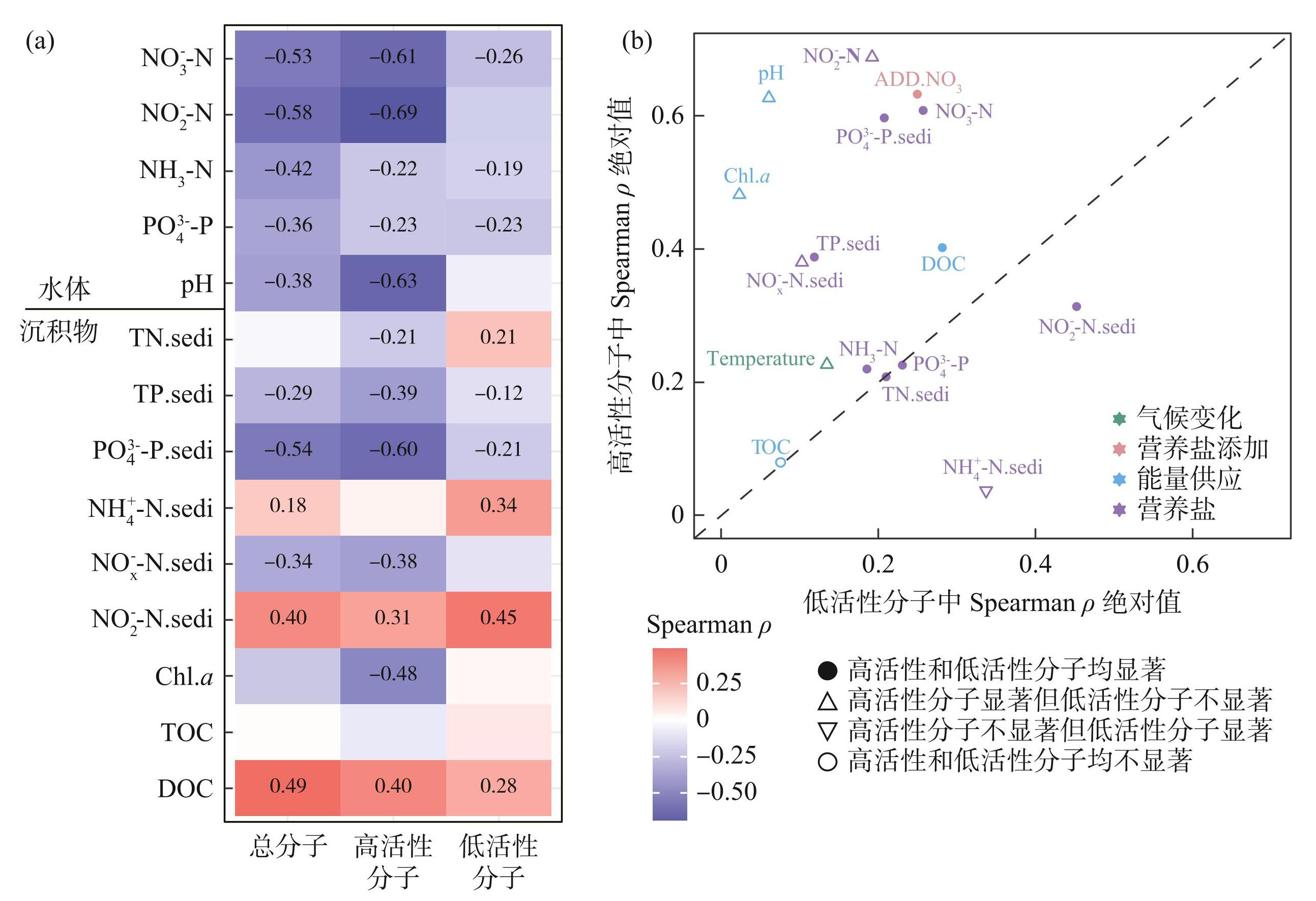
图4环境因子与总分子、高活性分子和低活性分子N/C比值的Spearman相关性
Fig.4Spearman's correlation between environmental factors and the N/C ratios for all, active and inactive molecules
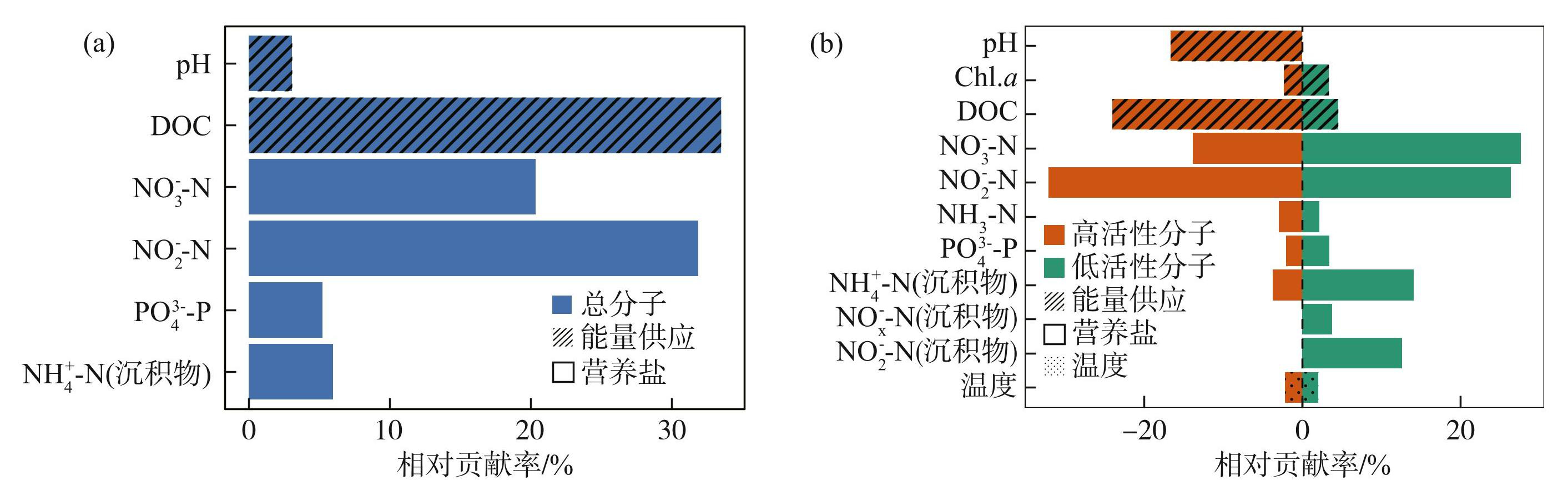
图5通过随机森林分析确定的解释变量对总分子、高活性分子和低活性分子N/C比值的相对影响: (a)为总分子;(b)高活性分子和低活性分子(仅显示相对贡献率大于1% 的变量)
Fig.5Relative effects of explanatory variables on N/C ratios for all, active and inactive molecules determined by random forest analyses: (a) all molecules; (b) active molecules and inactive molecules (only the variables with the relative contribution rate >1% were shown)
在高活性分子和低活性分子之间,N/C比值分布规律也存在显著差异,且高活性分子的 N/C比值高于低活性分子。这种差异主要归因于沉积物中N/C比值的高低直接影响到分子被微生物矿化的难易程度。具体而言,当沉积物N/C比值越高时,高活性分子越容易被微生物矿化[49],从而表现为相对较低的稳定性。此外,高活性分子和低活性分子的 N/C 比值与环境因子之间的相关性也存在差异。随着海拔的升高,高活性分子的 N/C 比值显著升高,而低活性分子则无明显变化。这一现象可能与不同海拔下温度的变化有关。在高海拔地区,温度较低,减缓了高活性分子有机质的矿化分解速率,从而影响了氮的矿化和分解过程[50-51]。相比之下,低活性分子由于本身稳定性较高,故温度对其影响较小。比如,在7—9月自然温度基础上对沉积物进行增温(+2.5℃)模拟实验研究发现,沉积物N/C比值随温度变化呈先下降后上升的趋势,且通过增温处理的N/C比值比自然温度下的N/C比值低。特别是在温度达到峰值的8月时,微生物活性因温度升高而增强,促进了有机营养盐的矿化[11];此外,温度升高会导致氨氮的释放,从而抑制硝化作用[52]。高活性和低活性分子N/C比值均随营养富集的增加而显著降低,而高活性分子与营养富集的关系更强。导致该变化趋势的可能原因有:(1)氮的输入抑制了对原生有机碳的矿化[50];(2)富营养化湖泊通常比寡营养湖泊积累更多的碳:一些厌氧或兼性厌氧的生物(如蓝藻等)在缺氧环境中能够大量生长繁殖,并通过光合作用或其他途径产生有机物,导致整个生态系统中初级产量较高,本底有机物分解较慢,沉积物固碳能力增强[53-55]。比如,在波兰开展的3个营养梯度的湖泊研究中,富营养湖泊的N/C比值比其他两个中营养湖泊的N/C比值低[49];而在塔尔湖的研究中,随着氮肥施用量的增加,沉积物的N/C比值增加,这可能表明较高施肥量提高了氮的吸收率[56]。此外,一些关于土壤N/C比值的研究表明,氮添加也会使土壤N/C比值上升[57]。比如,在黄土高原,较高的氮肥使用量和较好的耕地通风性增加了碳分解,提高了N/C比值[58]。在四川盆地与青藏高原交界地带的长期氮添加实验结果也表明氮添加会显著降低微生物碳的限制,从而导致N/C比增加[59]。
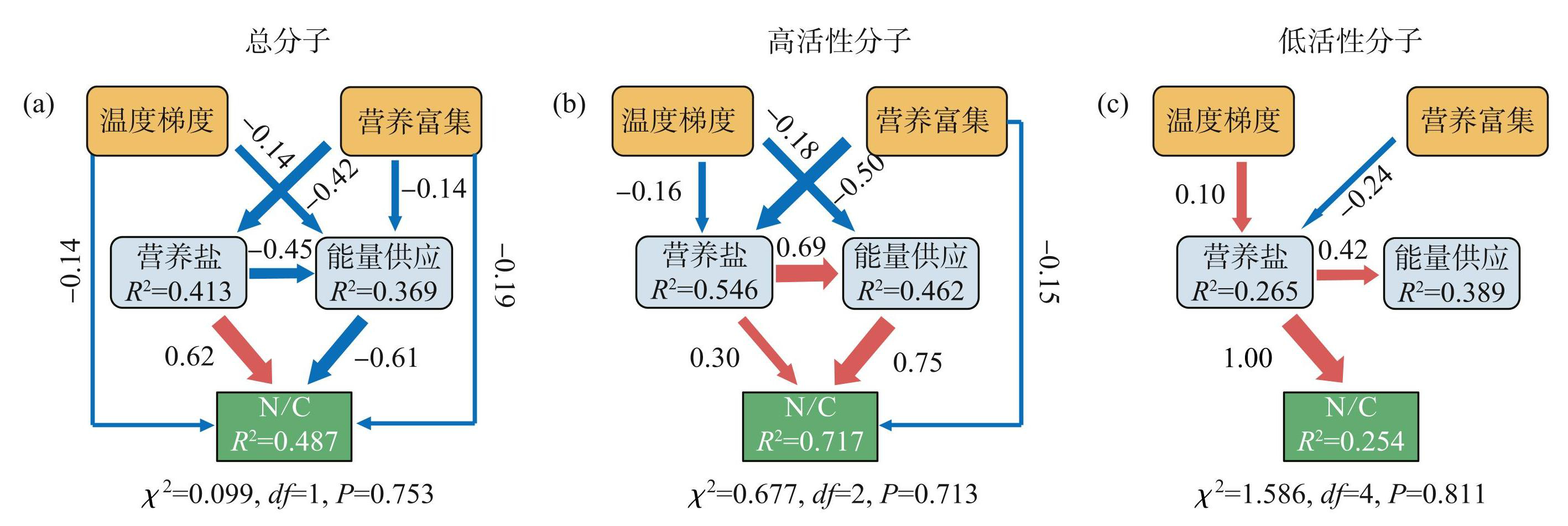
图6温度、营养富集、营养盐和能量供应对总分子、高活性分子和低活性分子N/C比值的直接和间接影响(红色和蓝色箭头分别表示正影响和负影响。实线和虚线箭头分别表示统计意义上的显著和非显著关系。箭头宽度和所附数字是模型的相对效应(即标准化路径系数)。卡方检验中,较小的χ2和较高的P值(P>0.05)表明模型与数据拟合得较好)
Fig.6Direct and indirect effects of temperature, nutrient addition, nutrients and energy supply on N/C ratios of all, active and inactive molecules (red and blue arrows indicate positive and negative effects, respectively. Solid and dashed arrows indicate statistically significant and non-significant relationships, respectively. Arrow widths and accompanying numbers are the relative effects (that is, standardized path coefficients) of modeled relationships. In the chi-square test, smallerχ2 values and higher P-values (P>0.05) indicate that the model fits the data well)
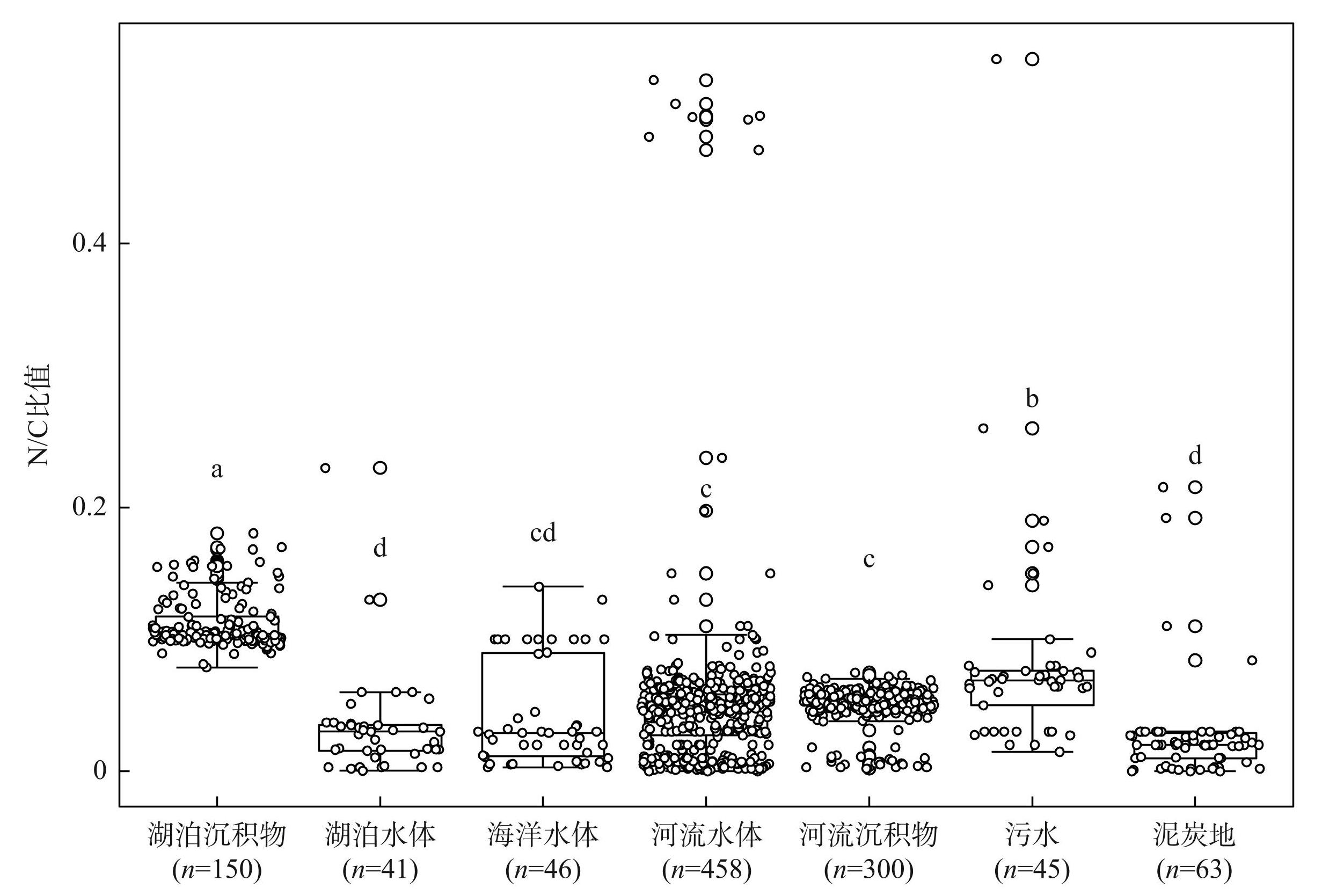
图7模拟实验中湖泊沉积物的N/C比值与基于Meta分析收集不同生境的N/C比值分布
Fig.7Distribution of N/C ratios in lake sediments from simulation experiments compared to Meta-analysis based collection of N/C ratios from different habitats
此外,本研究发现高活性分子与其他环境因子的相关性显著高于低活性分子,这体现在高活性分子N/C比值与大部分环境因子的之间相关性绝对值ρ均高于低活性分子。这可能与分子特性和难降解性有关,例如,相对于低活性分子,高活性分子的转化率更高[29]。此外,通过将其他环境因子分成两大类:营养物质和能量供应,其中营养物质和能量供应是影响高活性分子N/C比值的主要环境因子,而营养物质是影响低活性分子N/C比值的主要环境因子。上述结果表明,高活性分子对环境变化更敏感,但低活性分子N/C比值也受环境因子的影响,且低活性分子的丰度占总体溶解有机质分子的22.92%。因此,本研究结果与传统观点不同,认为低活性分子并不一定具有较强的稳定性,该研究领域值得在湖泊其他生境中进行更深入的研究。
4 结论
在以往研究中,总有机氮和总有机碳的比值是定量N/C比值的传统方法;随着高分辨率质谱FT-ICR MS等新兴质谱技术的发展,人们可以从分子等微观层面来定量分子水平以及群落水平的N/C比值[32]。通过Meta分析,本研究收集近十年以来有关溶解有机质N/C比值的数据,从宏观角度探究了全球湖泊、河流、海洋、污水和泥炭地N/C比值的分布。其中,湖泊主要受DOC的影响,河流主要受温度的影响,而污水和泥炭地主要受营养盐的影响。然而,全球数据显示,不同生境N/C比值受环境因子的影响存在差异,无法定量环境因子对N/C比值的相对作用。因此,为了进一步探究DOM分子N/C比值对环境因子的响应机制,本文开展了沿海拔梯度的微宇宙实验模拟温度变化和营养富集,揭示了溶解有机质总分子N/C 比值除了受营养富集的影响,还受亚硝酸盐和硝酸盐等营养盐的影响。在此基础上,通过转化数大小将分子划分为高活性和低活性分子,揭示了高活性溶解有机质分子N/C比值与总分子和低活性分子间存在显著差异,高活性分子的N/C比值显著高于总分子和低活性分子,且高活性分子的N/C比值受温度和营养富集显著影响。此外,对于其他环境因子而言,高活性分子对环境变化更敏感,但是研究还发现,低活性分子也受环境因子的影响,这与传统观点有所不同。
