摘要
极端洪水显著地影响水生植物的生存环境,带来的连锁效应可能是导致沉水植物大规模衰退的原因之一。极端洪水导致的外源营养、水位升高是影响沉水植物生长和繁殖的重要因素,因此以湖泊代表性沉水植物黑藻(Hydrilla verticillata)为对象,通过模拟研究探讨极端洪水事件导致的水位波动(水位在短时间内升高)及营养脉冲(营养物质在短时间内增加)对沉水植物、附着藻类和水体理化性质的影响。设置4种水位及营养盐负荷情景:对照(水位保持在75 cm)、水位由75 cm逐步上升到150 cm+氮磷输入、水位由75 cm急剧上升到150 cm+氮磷输入以及水位保持75 cm+氮磷输入,其中后3项处理氮、磷输入量相同,90 d内同步监测了浮游植物、附着藻类以及水体氮、磷浓度的变化。结果表明,对照组中,黑藻雌株相较于雄株个体更大,而极端降水(水位急剧上升)处理下,雄株的相对生长速率(RGR)、根生物量和繁殖器官数均大于雌株,表现出明显的性别二态性。雌性个体对水位波动(水位急剧上升和逐步上升)和营养脉冲的响应比雄性个体响应更为敏感。水位急剧上升和逐步上升均抑制了黑藻根生物量积累、RGR和主枝数,但株高、地上生物量和繁殖生物量保持稳定,水位急剧上升同时抑制了附着藻类的生长。营养脉冲提高了上覆水氮浓度,促进浮游植物和周丛藻类生长,对黑藻地上部分、根和繁殖生物量均有显著抑制作用。实验设置的水位范围内,水位升高对黑藻的地上部分生长及繁殖的影响不明显,而氮、磷输入增加及水位波动的联合作用抑制了其地上部分生物量及繁殖输出,因此营养脉冲增强了水位升高对黑藻的影响效应。由此可以认为,极端洪水事件引起的水位波动叠加营养脉冲的复合效应可能会对沉水植物产生明显的抑制作用,随着未来降水强度和频率增加,水生态系统将受到较大的冲击。
Abstract
Extreme flooding significantly affects the habitat of aquatic plants. Its knock-on effects may be one of the reasons for a massive decline in submerged macrophytes. Increased nutrient loading and rising water level are major factors affecting the reproduction and growth of submerged macrophytes. Therefore, we used H. verticillata, a typical submerged macrophyte in the lake, as the target species. A simulation study was conducted to explore the effects of water-level fluctuations (an increase in water level within a short period of time) and nutrient pulses (an increase in nutrient concentration within a short period of time) caused by extreme flooding events on the submerged macrophyte biomass, growth and reproductive traits, water physicochemical properties and periphyton. Four water level and nutrient loading scenarios were set up, i.e., control (stable water level of 75 cm), gradual increase of water level from 75 cm to 150 cm + N (nitrogen) and P (phosphorus) inputs, sudden increase in water level from 75 cm to 150 cm + N and P inputs, and stable water level of 75 cm + N and P inputs. The latter three treatments had identical total N and P inputs. Phytoplankton, periphyton, and N and P concentrations in the water column were monitored in a 90-d period. The results showed that the sizes of females were greater than those of males in the control, while the relative growth rate (RGR), root biomass and the reproductive organ number in males were higher than those in females in the extreme precipitation treatment (sudden change in water level). These findings demonstrated an evident sexual dimorphism in H. verticillata. Females responded more sensitively than males to water-level fluctuations (sudden and gradual water level change) and nutrient pulses. Both sudden and gradual increase in water level suppressed root biomass, RGR and the main branch number of plants, whereas plant height, aboveground and reproductive biomass remained unchanged. At the same time, a sudden rise in water level inhibited periphyton growth. Nutrient pulses increased the N concentration in the overlying water, promoted phytoplankton and periphyton growth, and significantly inhibited the biomass of shoots, roots and reproductive tissues. Within the designed range of water levels (75-150 cm), increased water level had no significant effect on the aboveground growth and reproduction of plants, while the combined effect of increased N and P inputs and water-level fluctuations had a negative effect on both aboveground biomass and reproductive output. Thus, the nutrient pulses aggravated the effect of water-level fluctuations on H. verticillata. In conclusion, the joint effect of water-level fluctuations superimposed on nutrient pulses caused by extreme flooding events will have a significant inhibitory effect on submerged macrophytes. With the increasing intensity and frequency of precipitation in the future, it would cause considerable impacts on aquatic ecosystems.
长江中下游地区浅水湖泊密集,是我国水生植物比较集中的区域之一[1]。然而,在全球气候变化、人类活动加剧等多重因素影响下,以鄱阳湖、洞庭湖为典型代表的浅水湖泊湿地自然水文特征发生明显变化,特别是近年来频繁受到极端洪涝和干旱气候的影响,水生植物生存和生物多样性保护受到严重威胁[2]。相关研究表明,随着全球气温升高,极端洪水增加趋势显著[3-4],使得浅水湖泊藻类暴发风险更大[5],给水生植物、水质以及生态系统结构带来了诸多影响[6-7]。沉水植物是水生生态系统中的初级生产者,稳定的沉水植物群落是维持浅水湖泊生态系统健康的基石,因此在当前气候变化背景下,探究极端洪水对沉水植物生长发育的作用,对深入理解浅水湖泊生态系统结构与功能的变化有重要意义。
极端洪水目前尚无通用的定义,其通常源于夏季极端降雨或温暖春季急剧融冰化雪引起的集水区下游湖泊、河流水量迅速增加或水位迅猛上涨[8]。一方面,水位波动节律改变对沉水植物的生长、繁殖和进化演替影响较大。洪水期间降水径流会导致水位短时间内显著升高,更高的水位可以迅速降低水体光照条件,影响植物光合作用、气体交换和养分吸收,这些生理过程的变化会进一步影响植物形态和生长[9-10]。另一方面,极端洪水是引起湖泊内氮、磷等营养元素变化的重要因素,对湖泊湿地水质以及生态功能具有深远影响。沉水植物与浮游植物及附着藻类之间具有相互竞争关系,极端洪水可能增加水体的外源营养物质输入,这些营养盐的波动性增加通常伴随浮游植物生物量的增加[11-12],导致沉水植物衰退[13-14]。例如,一些研究表明,洪水会影响浅水水体内/外源营养盐负荷及营养盐动态,水体物理条件(如透明度、氧气含量等),附着藻类、浮游植物、水生植物分布和生物量以及生态系统结构和功能[6,15-17]。浅水湖泊富营养化过程中普遍存在沉水植物种群的衰退、消亡现象,极端洪水事件增加将改变自然界营养物质对植物的供应状态,提高水溶性营养物质浓度,这种短时间内营养的脉冲式变化可以影响植物的生长代谢和功能性状[18]。因此,气候变化导致的极端洪水事件可能对世界范围内沉水植物的生长产生负面影响。
营养富集或水位波动对沉水植物生长与存活的影响已有深入报道,但沉水植物对极端洪水(氮、磷脉冲式变化叠加水位波动)的响应尚不明确。Cao等[19]野外调查研究表明,河流中极端洪水能降低入侵沉水植物伊乐藻(Elodea nuttallii)的生物量。Carrara等[20]结合控制实验和野外观测发现,本地物种洋野黍(Panicum dichotomiflorum)在恒定水位处理下有更大的生物量,而入侵水生植物齿叶臂形草(Urochloa mutica)在极端洪水条件下有更大的生物量。Zhi等[21]发现,在低营养清水型系统中,密刺苦草(Vallisneria denseserrulata)对营养负荷和水位变化联合作用的响应不明显;然而在富营养水体中,发现人工模拟洪水对苦草(V. natans)生长和繁殖有较大的不利影响[22]。这些研究结果的不一致性表明,水生植物对洪水或不同外源营养负荷条件具有物种特异性响应。此外,雌雄异株沉水植物(如苦草、伊乐藻、黑藻(Hydrilla verticillata)等)具有单性花,有研究表明雌雄异株植物的雌性和雄性个体可能对同一环境变化产生不同的响应,胁迫环境(如高水位、弱光)下水生植物雌性个体比雄性个体响应更为敏感[23-24]。然而,有关极端洪水对水生植物影响的研究大都不考虑雌雄个体的差异,许多实验是在没有开花的个体上进行的,因此这些研究几乎没有涉及水生植物的性二态特征。极端洪水对水生植物不同性别个体生长和繁殖的影响程度是否不同?目前有关研究还鲜有报道。
黑藻是湖泊常见优势沉水植物,多年生,冠层型,花单性,有雌株和雄株之分,它们广泛分布于欧亚大陆热带至温带地区。由于黑藻具有强大的生命力和繁殖能力,在一些地区(如北美洲、南美洲以及大洋洲局部地区)被认为是入侵物种[25]。黑藻常常分布于湖泊、河流水深为0.5~2 m的水域,且极端洪水造成长江中下游湖泊水位变幅为0.5~1 m的情况经常出现。本研究以黑藻为对象,模拟4种水文环境,研究极端洪水(氮、磷脉冲式输入×水位波动)对雌雄异株水生植物、附着藻类和水质的影响。本文的科学假设包括:(1)水位波动和氮、磷脉冲抑制沉水植物黑藻的生物量积累,改变生长形态和繁殖特征;(2)极端洪水显著地促进浮游植物和附着藻类生长,间接影响沉水植物生长;(3)沉水植物雌性个体对水位和营养脉冲的响应比雄性个体更为敏感。
1 材料与方法
1.1 研究区域概况
鄱阳湖(28°25′~29°45′N,115°48′~116°44′E)是中国第一大淡水湖和长江中游典型浅水、草型、通江湖泊。湖区属亚热带湿润季风气候,雨量丰沛,四季分明,多年平均气温为16.5~17.8℃,年平均降雨量为1400~1700 mm,主要集中在4—7月,约占全年降水的55%。鄱阳湖水生植被群落的优势物种由1983年(第一次鄱阳湖科学考察)的竹叶眼子菜(Potamogeton malaianus)变为2013年(第二次鄱阳湖综合科学考察)的苦草和黑藻。丰水季节,鄱阳湖处于湖泊景观时,黑藻是优势度较高的物种之一[26]。一些研究表明,黑藻在鄱阳湖国家级自然保护区、南矶湿地国家级自然保护区的碟形湖内分布较多[26-28]。黑藻有较强的适应能力和富集能力,是净化污水的理想植物。由于黑藻本身繁殖器官小及其所处环境的限制,目前对其有性繁殖方面的研究较少。
1.2 实验设计
实验在中国科学院鄱阳湖湖泊湿地观测研究站完成。2019年5月,实验材料采自鄱阳湖,选择相同规格大小的鄱阳湖黑藻顶枝148株(长(16.7±0.2)cm,鲜重(0.64±0.03)g),小心清除枝条上附着生物,随后将其单株培养于装有17 cm底质的塑料桶(直径20 cm,高19 cm)中。湖沙和鄱阳湖泥土以1∶4的比例均匀混合作为培养底质,总氮(TN)、总磷(TP)和有机质含量分别为(2.2±0.07)mg/g、(0.27±0.03)mg/g和6.8%±0.06%。
中宇宙控制实验系统由12个混凝土水池(2 m×2 m×1.7 m)组成。设置4个实验处理(对照(C)、一般洪水(G)、极端洪水(E)以及恒定水位+氮、磷添加(C+N)处理,图1),每个处理设计3个重复。采用随机区组设计,每个水池分配12~13个栽培桶,将其用绳子挂置于实验水池中,幼苗培养的初始水位为75 cm,适应时间为10 d。水位处理开始前,水体叶绿素a(Chl.a)、TN和TP浓度分别为(19.5±1.3)μg/L、(1.41±0.08)mg/L和(0.13±0.005)mg/L,各处理下各指标的初始值无显著差异(P>0.05)。
实验持续时间为90 d。C处理:0次水位波动,水位在75 cm处保持90 d,不添加N、P;G处理:3次水位波动,90 d内水位分3次从75 cm升高到150 cm,每次水位增加时添加1次氮、磷,总共添加3次;E处理:1次水位波动,实验开始时(第1天)水位从75 cm快速升高到150 cm,同时添加1次氮、磷;C+N处理:水位保持在75 cm处,实验开始时添加1次氮、磷。E、G和C+N 3个水位处理组总营养盐输入量相同(氮: 8000 mg/m2,磷: 187.5 mg/m2),通过添加KNO3和KH2PO4控制氮、磷营养元素输入。为了采集附着藻类,每个水池中竖直悬挂6块PVC板(20 cm×4 cm),其下边缘和栽培桶上边缘处于相同水深。每3 d进行1次水位监测,使其保持在实验范围内。每7 d于中午12:00—13:00用Li-COR UWQ-192SA水下光合有效辐射(PAR)传感器测定水深0、75、100、125和150 cm处的PAR值,均值分别为(2393±35)、(561±29)、(375±41)、(266±46)、(132±18)μmol/(m2·s)(P<0.001)。各处理组(C、C+N、E、G)水体光衰减系数分别为(0.029±0.01)、(0.0410±0.01)、(0.044±0.01)、(0.051±0.02)m-1(P<0.05)。实验期间水温为23.5~32.6℃。
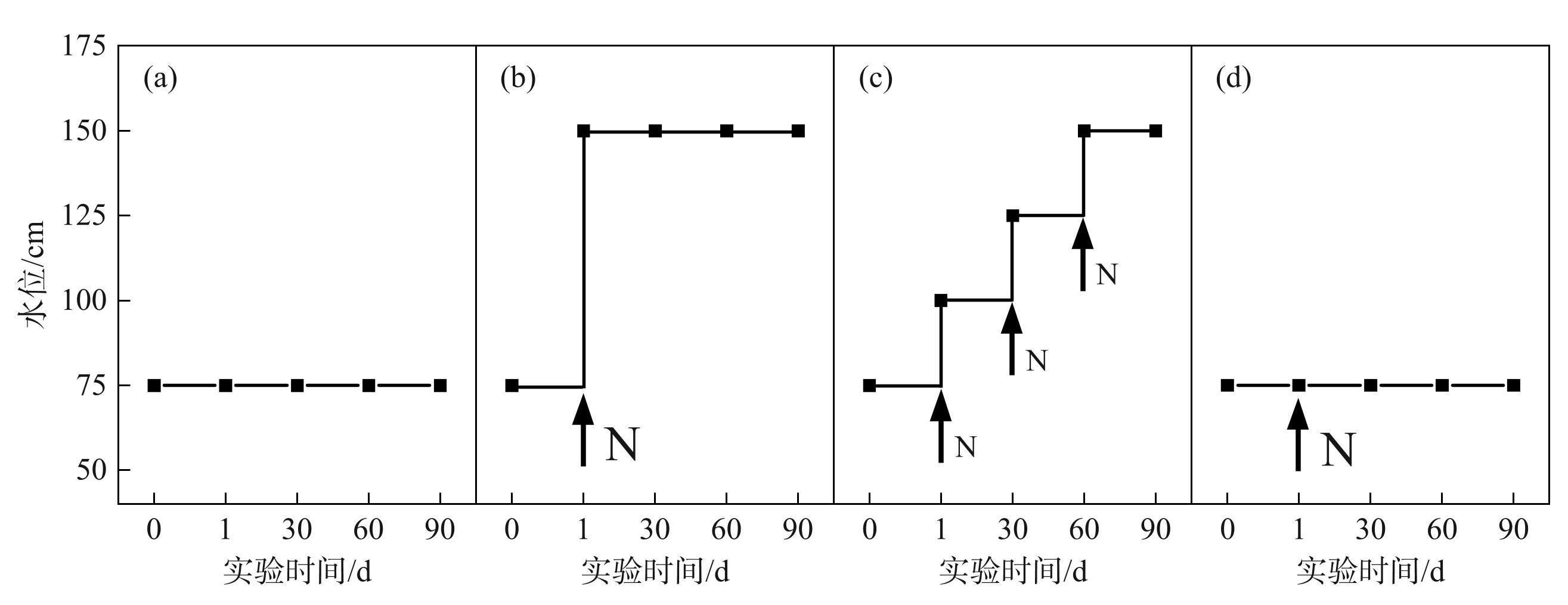
图1实验设计图解:(a)对照组C;(b)极端洪水处理组E;(c)一般洪水处理组G; (d)恒定水位+营养盐处理组C+N(黑色箭头表示该时间施加营养盐,字母“N”越大表示营养盐输入量越大)
Fig.1Schematic diagram of the experimental design: (a) C-control; (b) E-extreme flooding treatment; (c) G-normal flooding treatment; (d) C+N-constant water level + nutrient treatment (Black arrows indicate nutrient inputs at the time points. The larger the size of letter “N”, the greater the amount of nutrient input)
1.3 指标测定
自水位波动处理开始之日起的第15、30、45、60、75和90天采集水样和附着藻类。水体测定指标包括电导率(EC)、溶解氧(DO)、pH值、Chl.a、TN和TP。测定两种附着藻类:着生于沉水植物表面的附着藻类,定义为附植藻类;人工基质上的附着藻类,定义为周丛藻类。以单位面积的Chl.a含量(μg/cm2)表示二者的生物量。TN和TP浓度采用过硫酸钾氧化法测定[29],Chl.a浓度采用热乙醇法测定[30]。附植藻类每次采样时于每个水池中随机取1株黑藻,剪下第二长枝条,装入塑料密封袋,于4℃冷藏保存,沉水植物样品采集时需要尽可能小心,减少对附着藻类的干扰。每次向密封袋中加入约80 mL蒸馏水,震荡1 min,重复洗脱3次以去除枝条表面的着生藻类,收集的悬浮液经Whatman GF/F滤膜过滤,滤膜经-20℃低温保存24 h后采用热乙醇法测定Chl.a。周丛藻类每次采样时于每个水池中选取1块基质板,用约250 mL纯水清洗,保证全部清除附着生物,最终采用热乙醇法测定Chl.a。
实验结束(第90天)后采集所有植株,用自来水清洗干净,测定目标植物的株高、主枝数、分枝数。由于黑藻是雌雄异株,分别测定雌株、雄株的有性繁殖器官数量(雄性为佛焰苞,雌性为佛焰苞和果实)。将每个植株分成地上部分(枝条、繁殖器官)和地下部分(根),在75℃烘箱中烘干至恒重,测定生物量。相对生长速率RGR=(ln W2-ln W1)/Δt,其中W1代表实验开始时的植株生物量,W2代表实验结束后的植株生物量,Δt为实验天数。本研究中雌∶雄性比约为3∶1,各实验处理组雌、雄植株数量分别为26和11株(C组)、18和19株(E组)、34和3株(G组)、31和6株(C+N组)。
1.4 数据分析
采用广义线性模型(generalize linear model)评估不同实验处理(C、E、G、C+N)、性别以及它们之间的交互作用对黑藻生物量、RGR、主枝数、分枝数、株高和繁殖器官数的影响,并使用LSD检验进行事后多重比较(P<0.05)。采用双因素重复测量方差分析(RM-ANOVA)评估实验处理、取样时间以及它们之间的交互作用对水体环境因子(Chl.a、TN、TP、DO、EC和pH)、周丛藻类和附植藻类的影响,并使用Tukey检验进行事后多重比较(P<0.05)。在进行统计分析前,使用Shapiro-Wilk 检验评估残差是否服从正态分布,通过Levene 检验检测方差齐性。必要时进行数据转换(log10),以满足正态性和方差齐性假设。用IBM SPSS Statistics 27.0.1对数据进行统计分析。
2 结果
2.1 不同实验处理下黑藻的响应
实验处理显著地影响了黑藻根生物量(χ2=20.73,P<0.001)、繁殖器官特征(生物量(χ2=29.21,P<0.001)和数量(χ2=11.14,P=0.011))以及主枝数(χ2=19.98,P<0.001)(附表Ⅰ)。但黑藻雄株的所有指标在C、E、G和C+N处理组间差异不显著(图2)。黑藻雌株的根生物量在对照组(C组)最大,在E(水位急剧上升)和G(水位逐步上升)处理组最小(图2c)。相比于对照组,E、G和C+N处理组黑藻雌株的总生物量、地上生物量、繁殖器官生物量显著降低(P<0.05),并且E、G与C+N处理组间无显著差异(图2a、b、d)。黑藻雌株的RGR、主枝数在对照组最大,在E处理组最小(图2e、f),而分枝数在各处理组间无显著变化(2g)。对照组黑藻雌株的株高((167.6±1.4)cm)显著大于G((139.7±3.2)cm)和C+N((147.0±7.4)cm)处理组(P<0.05),而E处理组黑藻株高与对照组差异不显著((151.5±3.3)cm)(图2h)。黑藻雌株的繁殖器官生物量和数量均在对照组最大,而E、G与C+N处理组间无显著差异(图2d、i)。
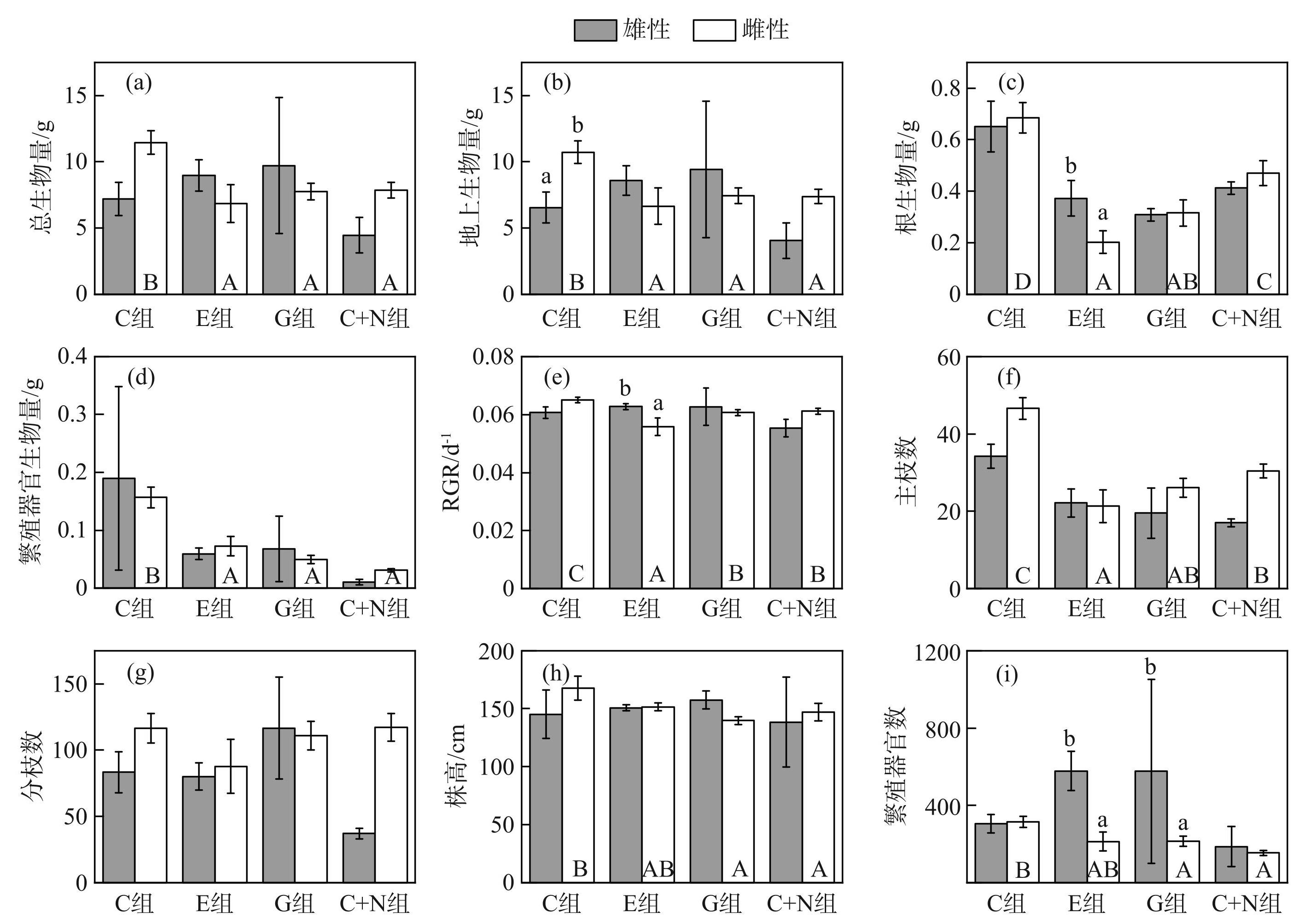
图2不同实验处理对黑藻雄性和雌性个体生物量、生长和繁殖性状的影响 (大写字母表示不同实验处理下同一性别个体之间存在显著差异(P<0.05),小写字母表示在相同实验处理下不同性别个体之间存在显著差异(P<0.05),竖线代表标准误)
Fig.2Effect of different experimental treatments on biomass, growth and reproductive traits of male and female H. verticillata individuals (Capital letters indicate significant differences among individuals of the same sex under different experimental treatments (P<0.05) . Lowercase letters indicate significant differences among individuals of different sexes under the same experimental treatment (P<0.05) . Vertical bars represent standard errors)
繁殖器官数受到性别的显著影响(附表Ⅰ; χ2=12.56,P<0.001)。E和G处理组雌性所产生的佛焰苞和果实少于雄性(图2i;P<0.001)。在对照组,黑藻雌株的个体大小(地上部分生物量)显著大于雄性(P<0.05),表现出明显的性别二态性,而E、G和C+N处理组雌、雄植株个体大小的差异不明显(图2b)。在E处理组,黑藻的RGR、根生物量表现出明显的性别差异(雌性<雄性;P<0.05),而RGR、根生物量在C、G和C+N处理组均无明显性别差异(图2c、e)。
2.2 不同实验处理下周丛藻类和附植藻类的响应
周丛藻类(F=9.56,P<0.01)和附着藻类生物量(Chl.a)(F=6.305,P<0.001)随时间显著变化(图3)。周丛藻类在G和C+N处理组随时间的增长趋势较为明显,而在对照组和E处理组保持相对稳定(图3a)。不同实验处理显著地影响了周丛藻类生物量(附表Ⅱ;F=10.65,P<0.01)。多重比较结果表明,周丛藻类生物量在G处理组中最大,平均值为(0.629±0.213)μg/cm2;其次为C+N处理组,平均值为(0.484±0.141)μg/cm2(表1);对照组和E处理组的周丛藻类生物量最小,分别为(0.116±0.017)和(0.184±0.046)μg/cm2。4个实验处理组的附植藻类生物量均处于较低水平(<0.1 μg/cm2),其中E处理组的附植藻类生物量((0.025±0.011)μg/cm2)相对较低,而C+N处理组的附植藻类生物量((0.077±0.016)μg/cm2)相对较高(图3b,表1)。
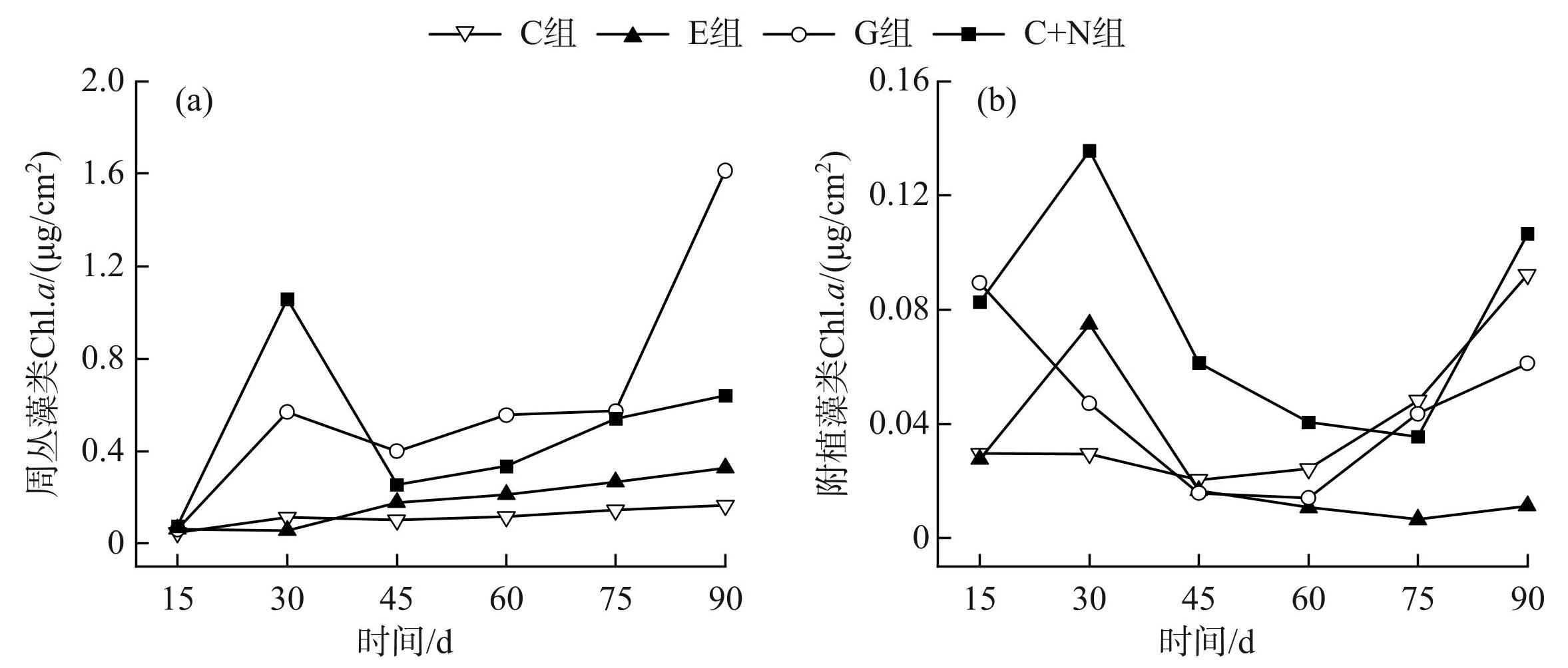
图3实验期间4 种实验处理下周丛藻类和附植藻类叶绿素a的变化
Fig.3Changes of periphyton and epiphyton chlorophyll-a under four experimental treatments during the experimental period
表1水体理化因子、浮游植物、周丛藻类和附植藻类生物量6次取样数据平均值(平均值±标准误)
Tab.1 Means of water physicochemical factors, phytoplankton, periphyton and epiphyton biomass for six sampling times (mean ± standard error)

2.3 不同实验处理下水质的比较
双因素重复测量方差分析结果表明,4个实验处理下TP浓度无显著变化(附表Ⅱ;F=1.004,P>0.05)。与对照组(Chl.a浓度平均值(8.456±1.362)μg/L)相比,E、G和C+N处理组上覆水的Chl.a浓度显著增加,分别为(29.909±9.212)、(38.092±7.914)和(40.228±18.811)μg/L。4个实验处理组水体TN浓度有显著差异(附表Ⅱ; F=3.576,P<0.05),对照组((1.005±0.051)mg/L)上覆水的TN浓度显著低于E((2.762±0.499)mg/L)、G((1.614±0.123)mg/L)和C+N((2.774±0.456)mg/L)处理组(P<0.05)。相比于对照组,电导率(P<0.001)和pH(P<0.05)在 E、G和C+N处理组显著升高(表1)。
3 讨论
气候变化在21世纪变得更加剧烈,未来极端洪水事件预计变得更强更频繁[31],这将对世界范围内沉水植物的生长、繁殖和进化演替产生深刻的影响。近年来,一些湖泊(如鄱阳湖、梁子湖、草海等)中沉水植物出现种群衰退趋势[6,26,32-33],其潜在原因值得关注。本研究从雌雄个体差异的角度探究极端洪水事件对雌雄异株植物黑藻生长和繁殖的影响,揭示极端洪水事件带来的水位升高和营养脉冲的单独及联合作用对水质、附着藻类及沉水植物的影响。研究发现,极端洪水对黑藻雌性个体的繁殖和生长(分枝数除外)产生显著影响,而雄性个体的生长和繁殖性状均无显著变化,可能是极端洪水导致的高水位或高营养负荷对黑藻雌性个体产生了更强的胁迫作用。从营养脉冲的单独作用来看(C+N与C处理比较)外源营养增加了上覆水Chl.a浓度,促进了附着藻类(周丛藻类)的生长。从水位的单独作用看,水位急剧升高(E与C+N处理比较)抑制了附着藻类(附植藻类和周丛藻类)的生长。营养脉冲和水位急剧升高的联合作用(E与C处理比较)增加了上覆水氮浓度,提高了上覆水Chl.a浓度、pH和电导率,但对附着藻类生物量的影响不大。
与地上生物量和繁殖器官生物量相比,发现黑藻雌性个体根生物量对水位升高的响应更为强烈。水位急剧升高或逐步升高(E、G与C+N处理比较)时,雌株根生物量受到显著抑制,而株高、地上生物量、总生物量以及繁殖器官生物量和数量均无显著差异。植物的株高通常代表植物的捕光能力,G和E处理组黑藻雌株株高为140和152 cm,接近甚至超过了最大水深。上述结果表明,冠层型沉水植物如黑藻能够通过功能性状的权衡(茎伸长快速生长到水面、根系生长受到抑制)来获取足够的光照,从而在一定程度上减小水位改变的不利影响,但存在适应上限。这与Guo等[34]用形态学+转录组揭示黑藻对弱光胁迫的响应和适应的研究结果一致。吴晓东等模拟水深梯度(0.5~4 m)的研究发现[35],水深1.5 m处黑藻生物量最大,水深2 m处黑藻株高达到最大而生物量减小。相较于莲座型沉水植物苦草[22],冠层型沉水植物黑藻地上生物量对水位升高的响应不一致,这个结果可能是不同物种光补偿点不同造成的。然而,水位升高对苦草和黑藻根系的生长均造成抑制,这可能会导致沉水植物根系锚定力和营养吸收能力下降[36],对沉水植物的生存、分布和群落组成产生潜在影响。水位上升、光照减弱不仅抑制沉水植物生长,对浅水湖泊藻类的生长与分布也会产生显著影响。有研究表明,光是湖泊沿岸带附着藻类生产力的主要驱动因子,由于光照强度随着水深的增加而迅速递减,附着藻类生物量也随之降低[37],本研究的结果与其一致。
氮和磷是沉水植物正常生长发育必不可少的营养元素,而水体中营养盐浓度超过一定水平后,会产生胁迫作用,导致沉水植物生长受到抑制,甚至死亡。研究发现,相比于对照组,E、G和C+N处理组中TN浓度、电导率、pH均显著升高,C+N处理组中黑藻雌株生物量(总生物量、地上和地下部分生物量)、生长性状(RGR、枝条数和株高)以及繁殖性状(繁殖器官生物量和数量)均显著下降。这些结果可能是由于营养负荷增加(E、G、C+N与C处理比较)导致氮浓度过高,促进浮游植物和周丛藻类的生长并形成遮荫作用,从而不利于沉水植物生长[38]。Wang等[39]研究表明,导致长江中下游湖泊沉水植物衰退的水体Chl.a浓度临界阈值一般在10 μg/L以上。本研究发现E、G和C+N处理组Chl.a浓度为29.9~40.23 μg/L。Zheng等[40]在模拟实验研究中发现,蓝藻通过化感作用抑制了竹叶眼子菜幼苗的光合作用,降低了生物量和叶绿素含量。高浓度氮还可能直接对沉水植物形成生理胁迫(如干扰碳氮代谢、造成氧化损伤等),从而改变植物生长和形态特征[41-42]。另外,有研究证明营养负荷增加显著抑制了黑藻雌性个体有性繁殖器官的产生(即繁殖输出),这可能意味着富营养化对植物繁殖的影响在以前的研究中被低估[43]。大量研究表明,水体营养负荷增加导致浮游植物和附生植物大量繁殖,光衰减增加[13]。营养负荷增加会改变底栖初级生产者竞争优势,附着藻类与沉水植物生物量呈显著负相关[44]。本研究结果与这些研究结果一致。因此,极端洪水携带的高浓度营养盐会对沉水植物和水生态系统造成较大的不利影响[18]。
研究发现,极端洪水处理下黑藻雌性个体的根生物量、RGR和繁殖器官数小于雄性个体,表现出明显的性别二态性,而对照组的黑藻未表现出明显的两性差异,暗示着雌性的这些性状在极端洪水影响下下降的程度大于雄性。本研究也发现,极端洪水下黑藻雌性个体地上生物量受到的抑制作用明显大于雄性个体。上述结果说明在不利环境(高水位、高营养负荷)下黑藻具有性别特异性响应,雌性个体对极端洪水的响应更为敏感。这可能是由于雌雄异株植物的雌株和雄株间存在不同的繁殖成本和环境适应性。一般来讲,雌性形成配子及孕育后代所需的资源远高于雄性,因此雌性趋向于将更多的资源投入到繁殖当中,而雄性则将更多的资源投入到生长当中,从而导致雌雄植株的地上生物量对环境胁迫表现出显著的性别响应差异,其中雄株对环境胁迫有更好的耐受性和适应能力[23,45-46]。一些研究发现,由于繁殖成本和生长之间存在着权衡,苦草、刺苦草(V. spinulosa)等雌雄异株沉水植物在资源有限或环境压力大的情况下(如高水位、低光、环境激素污染等)表现出性别响应差异[47-48]。例如,Zhou等[24]表明苦草的不同性别对水深有不同的响应方式和程度,并且雌性是对环境变化更为敏感的一方,从而导致性二态的个体大小在不同水深下存在差异,本研究结果与其一致。此外,在本研究中,极端洪水对黑藻雄性个体的繁殖器官生物量无显著影响,而雌性个体的繁殖生物量受到显著抑制,这说明雌性个体在不利环境下繁殖投入的响应比雄性更敏感。这可能是由于雄性功能对氮的需求量较大(因为花粉富含氮),相反,雌性功能对碳的需求量较大(因为种子富含碳),因此雌性繁殖更容易受到光和CO2的限制。该结果与Li等[48]有关低光胁迫对刺苦草雌株、雄株生长和繁殖策略影响的研究结果一致。气候变化下,雌雄异株植物性别响应差异会导致其群体模式发生改变,可能导致性别比例失衡甚至灭绝,最终会影响到生态系统结构和功能[46]。
水位升高和外源营养输入的联合作用(E、G与C处理比较)显著降低了黑藻雌性个体总生物量、地上生物量和繁殖器官生物量。实验设置的水位范围内,水位增加对黑藻地上部分生长及繁殖的影响不明显,而营养负荷增加抑制黑藻的地上部分生长及繁殖,因此外源营养输入增加增强了水位升高对黑藻的影响效应。由此可以认为,极端洪水事件引起的多种环境变化的叠加效应对沉水植物产生明显的抑制作用,随着未来降水强度和频率增加,水生态系统将受到较大的冲击。深入研究全球气候变化背景下极端洪水对沉水植物的影响,能够为今后水生生态系统的管理提供科学依据和数据支持。
4 结论
1)水位波动(水位急剧上升和逐步上升)抑制了冠层型沉水植物黑藻根生物量积累、RGR和主枝数,但株高、地上生物量和繁殖生物量保持稳定;水位急剧上升抑制了附植藻类和周丛藻类的生长。
2)营养脉冲提高了上覆水氮浓度,上覆水营养物质的增加反过来促进浮游植物和周丛藻类生长,对黑藻地上部分、根的生长和繁殖输出均有显著抑制作用。
3)极端洪水事件引起的水位波动叠加营养脉冲的复合效应会对水生态系统造成强大冲击,雌雄异株植物黑藻不同性别间的响应强度存在明显的差异,雌性个体表现出更高的敏感性。
5 附录
附表Ⅰ和附表Ⅱ见电子版(DOI: 10.18307/2025.0132)。
